|
Toxocariosis
Dr.
Humberto Alvarez Bianchi (*)
Introducción
Nuestro objetivo es hacer comprender a médicos y científicos de la salud,
la importancia y manejo de esta enfermedad cada vez más frecuente y no
conocida por la mayoría.
En el Perú, Maguiña y col.(1), describieron la enfermedad en 1987, otros
(2,4) han publicado trabajos pero no tan numerosos, como en Brasil, USA,
Europa y a nivel mundial.
Definición
Es una zoonosis ósea enfermedad de perros, cánidos y gatos), transmisible
al hombre, en ciertas condiciones epidemiológicas, produciendo en éste
el "SÍNDROME DE LARVA MIGRANS VISCERAL" (LMV).
Etiología y epidemiología
El agente etiológico es el Toxocara canis (más del 70% de casos humanos),
pudiendo ser también el Toxocara feli o Toxocara cati. Son los ascárides
del perro y del gato, respectivamente, hospederos definitivos de éstos.
El hombre es un hospedero paraténico, al albergar las larvas de toxocara,
sin llegar al estadio de adultos (14).
T.canis, es un nemátodo, mide 4-6cm (el macho) y 6.5-10cm.de longitud
(la hembra). Los huevos son los agentes infectivos, esféricos, de 85x75µ
de diámetro, cuando son expulsados con las heces del animal, en un principio
no son infectivos para el hombre o los animales.
| FIGURA
1 |
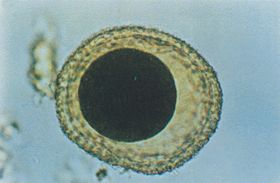 |
|
Huevo fertilizado no embrionado de Toxocara canis
|
En el
medio ambiente, con humedad y temperatura adecuadas, se transforman en
huevos larvados (infectivos) a 4-5 semanas de la expulsión. Una hembra
adulta puede eliminar hasta 200,000 huevos diarios, pudiendo un solo perro
o gato contaminar los suelos con millones de huevos, según la intensidad
del parasitismo. Al ser ingeridos por el animal, siguen similar ruta que
el Ascaris lumbricoides, el "Ciclo de Loos". Las larvas también pueden
migrar a los músculos, donde quedan en latencia, o cuando la perra está
preñada pudieran infectar a sus crías, vía transplacentaria y por lactancia.
En Chile(2) existe infección de 23-40% en perros < de un año de edad.
El parasitismo de perros en la ciudad de Lima es de 31.9%, principalmente
en animales < de 8 meses; y el grado de contaminación del suelo, en los
parques públicos (11 distritos): 80% en invierno y 70% en verano (4).
De los factores epidemiológicos y ecológicos dependerá que exista una
mayor o menor presencia de huevos en los ambientes públicos abiertos(4,5,6);
para otros la contaminación de algunas verduras, serían vehículos de los
huevos(8). Finalmente, según las técnicas de laboratorio, habrá una variación
en el porcentaje de positividad (9).
La tasa de infección en humanos en diversos países, depende de: salud
pública, educación sanitaria, costumbres y ocupaciones de los pobladores
y también de la demostración de anticuerpos antitoxocara (ELISA), empleando
larvas de segundo estadio, con antígenos excretores, secretores (10).
En Lima, en un estudio multicéntrico(4), de 1,023 personas, de entre 16-45
años o más, la tasa de infección fue de 7.33%. Además presencia de anticuerpos
antitoxocara con mayor prevalencia en personas > 45 años (hasta en 11.5%),
lo cual nos indicaría, que los anticuerpos perduran muchos años, ya que
los niños de corta edad son los que hacen la enfermedad sintomática y
no los adultos, lo cual llama la atención para que el médico dilucide
si una persona tiene enfermedad activa o es un simple infectado, que hizo
la enfermedad y que es sólo un portador del parásito en su forma larvaria.
Las cifras de infección, en países desarrollados, como USA varía del 2.8%-23.1%
ó más, y en una población infantil, al Sur (rural), llegó al 54% de seropositividad
(11, 12).
Manifestaciones clínicas y patológicas
| FIGURA
2 |
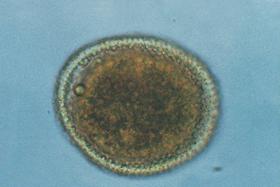 |
|
Huevo fertilizado no embrionado de Toxocara cati
|
Luego
de ingeridos los huevos infectivos, por acción de los jugos digestivos,
es liberada la forma larvaria, de 16-20 mm y penetrando ésta en la circulación
sistémica, puede causar en los tejidos hemorragia, necrosis y secundariamente
inflamación por reacción inmune del hospedero. La distribución y sobrevivencia
de las larvas, traerá como consecuencia hipereosinofilia de 60-80% (9).
Además se producen granulomas de 1 a 2mm de diámetro, alrededor de la
larva, que pudieran infectarse con gram (-) y gram (+) (estafilococo):
abscesos piógenos con sepsis, y potencialmente deceso del individuo(13).
Consecuencia de las alteraciones inmunológicas sistémicas, inducidas por
las larvas, es la inmunodeficiencia relativa que diseminaría las bacterias.
Las manifestaciones clínico-patológicas son ocasionadas por las larvas
migrantes, de allí el nombre de LMV. Durante la migración por la vía venosa,
el primer órgano comprometido, es el hígado: los granulomas en mayor proporción,
en la fase invasiva (14). También se comprometen el corazón, pulmones,
ojos, cerebro y otros. Se produce el pulmón eosinofílico y lo que se denominaba
el "Síndrome de LOEFFLER", radiológicamente una pneumonitis o diversas
lesiones, simulando una TBC miliar. Si agregamos que el paciente-niño
tiene tos con expectoración hemoptoica, dificultad respiratoria (disnea)
hepato y esplenomegalia, con fiebre alta, puede catalogársele como una
TBC miliar y sometido a terapéutica específica, un simple hemograma nos
dilucida el problema(16). En los casos de compromiso ocular (OLM), Miranda
(17) presenta 21 pacientes, con manifestación de estrabismo y disminución
de agudeza visual. Granulomas periféricos centrales en un 42.8%, serología
generalmente baja.
Diagnóstico
En base a datos epidemiológicos (geofagia, tenencia y contacto con perros,
gatos), cuadro clínico, serología (ELISA) específica positiva a títulos
elevados, hipergamaglobulinemia, eosinofilia marcada en fase invasiva.
Además Rx pulmonar con lesiones uni o bilaterales y biopsia hepática.
Diagnóstico diferencial con procesos infecciosos generales (PIG), TBC,
hepatitis, etc.
Tratamiento
Los medicamentos del grupo de los benzimidazoles (thiabendazol, albendazol)
a dosis x 1-3 sem. La Ivermectina puede ser utilizada x 1-3 días.
En toxocariosis ocular (OLM), corticoides (prednisona 30-40 mg/día, x
3 semanas); y gotas de corticoides de uso tópico.
Pronóstico
Variable, dependerá de la cantidad de inóculo absorbido, de la susceptibilidad
del hospedero, reacción inmune adecuada, de reinfestaciones frecuentes,
del estado de salud previo, y de la precocidad del tratamiento.
Prevención y control
Educación sanitaria, divulgación de enfermedad e higiene personal. Control
de perros vagos, gatos. Tratamiento y evaluación de mascotas, por el médico
veterinario.
Bibliografía
1.
Maguiña, C; Hernández, H; Gotuzzo E. et. al. L.M. visceral. 1º reporte
en el Perú. Rev. Med. Her. 1991; 2 (1):14-17.
2. Reyes, M; Díaz, G; Elías, J.C; y Rodas, K. Relación de toxocariosis
canina domiciliaria y larva migrans, en niños del distrito "El Agustino",
Octubre 1998. Revista Peruana de Parasitología. 1999; 14; 98-101.
3. Sánchez, T; Pradenas, C; Torres, M. y Canales, R.M. Síndrome
de LMV. Toxocariasis: Enfermedad transmitida por perros. Rev. Chil. Infect.
1994; 11: 17-22.
4. Zevallos, L.S; Chieffi; Pérez, B; et. al. Soil Contamination
and Human Infection by Toxocara sp. in the urban area of Lima, Perú. Mem.
Inst. O. Cruz, Nov. / Dic 1998; 93(6):733-734.
5. García, E. Prevalencia de Helmintos gastrointestinales en canes
familiares en el distrito de Lurigancho, Chosica, Lima. Tesis de Med.
Vet. UNMSM. 1974.
6. Chieffi, PP; E, Muller E.E. Estudo da variaçao solo por ovos
de toxocara sp., Una zona urbana del municipio de Londrina estado de Paraná.
Brasil. Rev.Inst.A.Lutz,1978;38(1):13-16.
7. Guerrero, M. A. Estudio de la contaminación de parques públicos
de Lima Metropolitana con huevos de Toxocara sp. Tesis Bachiller Med.Veter.
UNMSM. Lima 1975.
8. Vásquez, T. O; Martínez, B. Y; Tay, Z. J. et al. Vegetables
for Human consumption as probable source of Toxocara sp. infection to
man. Bol.Chil.Parasitol. 52 (3/4) 47-50. 1997.
9. Dada, B. J. A new technique for the recovery of Toxocara eggs
of soil. J. Helmintol. 1979;53:141-144.
10. DH de Savigni, Tixard. Trans.Royal Soc.Med.Trop.Hyg. 1977;71:501-507.
11. Weston, P; Dormans, L. Seroprevalence of Zoonotic Toxocariasis
in the USA: 1971-1973 Am.J.Epiderm 1985;122 (5): 890-896.
12. Jones, WE; Shantz, P; Foremank et. al. Human toxocariasis in
a rural comunity. Am. J. Dis. Child. 1984;134:967.
13. Ahmed, R.A; Lambertucci, J.R. A assocáo entre a toxocariase
humanae os absessos piagénicos. Rev. Da Soc. Bras. Med. Trop. Jul. Agosto
1999; 32 (4): 425- 438.
14. Beaven, P.C. Parasitological Review larva migrans. Exp. Parasitol.
1956; 5: 597-621.
15. Lambertucci, JR; Teixeira, R; Pereyra, FAL. Abscesso piogénico
de figado: analise do 50 casos. Revista do sociedade Brasilera do Medicina
Trop. 1991;24:83.
16. Roig, J; Romen, J; Rieva, C; Toxido, A; Morera, D. Acute eosinophilia
pneumonia due to Toxocariasis with bronchoalveolar lavage findings.Chest
1992;102:294-296.
17. Miranda Souza I. A. Toxocariasis ocular; Análisis de 21 casos.
Tesis Med. Cirujano UPCH. 1990-1996. Lima.
(*) Profesor Principal de Medicina. Miembro
del Instituto de Medicina Tropical "Alexander von Humboldt", Universidad
Peruana Cayetano Heredia.
|

