|
Influencia
del ácido triyodo - tiroacético (TRIAC) sobre algunos componentes
del síndrome metabólico
Dr.
Mario Zubiate Toledo (*)
RESUMEN
Veintisiete sujetos,
10 varones y 17 mujeres, entre 29 y 73 años de edad, fueron sometidos
a un estudio de tres etapas con el propósito de evaluar la influencia
del ácido triyodo-tiroacético (TRIAC) sobre los componentes
del "síndrome metabólico": a) estado basal, b)
ocho semanas con dieta hipocalórica y TRIAC o PLACEBO y c) ocho
semanas de dieta hipocalórica y PLACEBO o TRIAC. La administración
de TRIAC o PLACEBO fue hecha aleatoriamente. Se comprobó mejora
estadísticamente significativa, tanto en varones como en mujeres,
en la relación abdómino-glútea (RAG) lo mismo que
en la relación de áreas bajo la curva de insulina/glucosa
(AREA). También se apreció disminución significativa
(p < 0,05) en el IMC y en triglicéridos (TG) en varones y en
el colesterol total (ColT) en mujeres.
Palabras clave:
Acido triyodo-tiroacético (TRIAC), síndrome metabólico,
índice de masa corporal, relación de áreas bajo la
curva de insulina/glucosa (AREA).
SUMMARY
Twenty-seven subjects,
10 males and 17 females, between 29 and 73 years of age, were submitted
to a three step study in orden to evaluate the influence of the triiodo-thyroacetic
acid (TRIAC) on the components of the "metabolic syndrome":
a) basal condition; b) eight weeks with an hypocaloric diet and TRIAC
or PLACEBO, and c) eight weeks with the same hypocaloric diet and PLACEBO
or TRIAC. TRIAC and PLACEBO were distributed in an aleatory way. A statistically
significant improvement (p<0,05), both in males and females, was observed
in the waist/hip ratio and the insulin/glucose ratio of areas under the
curve. A significant decrease of BMI and triglycerides in males and total
cholesterol in females was demonstrated as well.
Key words:
Triiodo-thyroacetic acid, metabolic syndrome, body mass index, waist/hip
ratio; insulin/glucose ratio of areas.
INTRODUCCIÓN
Alberti y Zimmet (1)
han propuesto una definición simplificada del "Síndrome
Metabólico" con el propósito de permitir más
amplios estudios epidemiológicos en poblaciones en las que la metodología
más sofisticada no está al alcance de los investigadores,
SINDROME METABOLICO:
(definición simplificada)
Es la Tolerancia disminuida
a la glucosa (TDG) o diabetes mellitus (DM)
y/o insulino - resistencia (IR) (*)
A estos elementos
se debe agregar 2 ó más componentes de la siguiente lista:
- Obesidad central:
Relación abdomino - glútea (RAG) mayor de 0.9 en varones
y mayor de 0.85 en mujeres
y/o
- Obesidad con índice
de masa corporal (IMC) mayor de 30 kg/m2
- Hipertensión
arterial (HTA) igual o mayor de 160/90 mm Hg.
- Triglicéridos
(TG) iguales o mayores de 150 mg/dl
y/o
- Colesterol HDL
menor de 35 mg/dl en varones y menor de 39 mg/dl en mujeres
- Microalbuminuria
(malb) igual o mayor de 20 ug/min
o
- Relación
albúmina/creatinina (alb/cr) igual o más de 20 mg/g en
orina
El Síndrome Metabólico ha recibido diversas denominaciones
y sus componentes han variado desde un simple "terceto" hasta
un más complicado "onceto" (1-6,9). El eslabón
inicial de estas cadenas que conducen a morbi-mortalidad cardiovascular
por ateroesclerosis, es la obesidad y más específicamente
la obesidad central (7,8). Ambas representan la punta del iceberg que
sobresale de la superficie del mar. Son la parte más fácilmente
detectable o visible del conjunto y nos deben obligar a buscar los componentes
todavía ocultos:
1. Hipertensión
arterial (HTA),
2.Disregulación del metabolismo de glucosa:
a) Hiperglicemia de
ayuno no diabética,
b) Tolerancia disminuída a la glucosa y
c) DM tipo 2
3. Hiperinsulinemia/insulinoresistencia,
4.Dislipidemia (triglicéridos altos/cHDL bajo) y
5. Microalbuminuria.
Por lo expuesto se puede concluir que:
La obesidad constituye
un importante factor de riesgo en el desarrollo de morbi-mortalidad cardiovascular.
La Organización
Mundial de la Salud (OMS) se ha pronunciado al respecto a través
de la publicación de la consulta que hiciera a un grupo de especialistas
en la materia. El documento titulado: "OBESITY Preventing and
managing the global epidemic" (10) destaca la importancia de
la obesidad como factor creciente de riesgo de salud para toda la humanidad.
La obesidad ya no puede ni debe ser considerada sólo como un problema
de estética o de falta de voluntad del obeso para seguir un régimen
dietético. Es una enfermedad crónica, similar, por ejemplo,
a la hipertensión arterial o diabetes, que requiere de control
y tratamiento permanentes (10, 11). El riesgo de salud del exceso de peso
se inicia ya con moderado incremento de peso o en la primera etapa de
la enfermedad: Pre-obesidad, con índice de masa corporal (IMC)
entre 25,0 y 29,9 kg/m2. Adicionalmente se subraya también que
la cintura no debe ser mayor de 94 cm. en el varón y de 80 cm en
la mujer (10, 12).
En conclusión,
pre - obesidad y obesidad deben ser tratadas. El tratamiento comprende
:
- Régimen
alimenticio
- Actividad
física
- Modificación
de hábitos nocivos
- Tratamiento
farmacológico
- Cirugía
El tratamiento farmacológico
es un aspecto que está evolucionando rápidamente. Sus metas
actuales están ya no tanto en conseguir un "peso ideal"
sino más bien en lograr una reducción de peso suficiente
como para disminuir los "riesgos de salud". Adicionalmente se
persigue el "mantenimiento" del peso alcanzado (13, 14).
En 1952 Gross y Pitt-Rivers,
simultáneamente con otros investigadores, identificaron una sustancia
desconocida hasta el momento y con estructura química emparentada
con las hormonas tiroideas, la 3,5,3' - triyodotironina (15). Su derivado
acético, el ácido 3,5,3'- triyodotiroacético, denominado
TRIAC, ha sido estudiado por numerosos investigadores. Dichos estudios
permiten llegar a las siguientes conclusiones respecto a sus propiedades
farmacológicas:
1. TRIAC es el resultado
de procesos de deyodinación de las hormonas tiroideas y se encuentra
en el suero en concentraciones fisiológicas de alrededor de 8.7
ng/dl (16).
2. Su tiempo de vida
media es de 5 horas y su aclaramiento se ha calculado en 60 a 70 L/día
(17).
3. TRIAC marcada con
isótopos se une en un 75% a la pre-albumina (TBPA) y en un 25%
a albúmina (18).
4. Debido a su limitada
unión a TBG (Tyroid Binding Globulin) se considera que TRIAC no
interfiere con el normal transporte de las hormonas tiroideas (19).
5. Los efectos biológicos
de TRIAC se deben a su ligazón con los receptores de las hormonas
tiroideas; sin embargo, sus acciones metabólicas son débiles
posiblemente debido a la rapidez de su eliminación (20-24).
6. TRIAC es más
liposoluble que hidrosoluble; por tal motivo se fija mejor en el tejido
adiposo y posee actividad lipolítica selectiva periférica
de acuerdo a los estudios de Hachem y Burgoin en adipocitos aislados de
rata lo mismo que en biopsias de tejido adiposo humano (25, 26).
7. También
se ha comprobado que TRIAC inactiva la fosfodiesterasa de los adipocitos
permitiendo un efecto más prolongado del AMP cíclico que
favorece mayor formación de lipasa activa (27).
8. Otra acción
favorable de TRIAC es que disminuye los niveles de colesterol tanto en
animales como en humanos (28, 29).
El ácido 3,5,3'
triyodotiroacético TRIAC es un análogo natural de triyodotironina.
Comparte con esta hormona varias de sus características bioquímicas
y fisiológicas. Se considera que, a semejanza de T3, sus acciones
pueden ser extranucleares o no genómicas y entre ellas están
la respiración y morfología celulares, el tono vascular
y la homeostasis iónica (30). También se destacan efectos
a nivel nuclear o "genómicos", de inicio mucho más
lento pero también de efecto más prolongado. Estos efectos
requieren de receptores específicos (TR) y éstos a su vez
de secuencias de nucleótidos de DNA o "elementos de respuesta
a T3" (TREs). Estas secuencias son comunes para los receptores de
estrógenos, glucocorticoides, PPAR y otros (31-33).
Teniendo en mente
todo lo mencionado previamente se decidió evaluar los posibles
efectos de TRIAC sobre algunos de los elementos del Síndrome Metabólico.
OBJETIVOS GENERALES
Estudiar la influencia del ácido triyodotiroacético (TRIAC)
sobre los componentes del "Síndrome Metabólico":
obesidad, obesidad central, hipertensión arterial, dislipidemia,
tolerancia disminuida a la glucosa, diabetes mellitus, resistencia a la
insulina e hiperinsulinemia, todos los cuales son factores de riesgo para
patología cardiovascular ateroesclerótica.
OBJETIVOS ESPECÍFICOS
Probar que la asociación
de dieta hipocalórica - TRIAC reduce significativamente el riesgo
de enfermedad cardiovascular, modificando favorablemente los componentes
del "síndrome metabólico", en comparación
con el grupo tratado con la asociación dieta hipocalórica-PLACEBO.
DISEÑO Y METODOLOGÍA
Diseño
del Experimento
Fueron estudiados
50 sujetos, 32 mujeres y 18 varones (Anexo 1). Como
criterios de inclusión fueron considerados inicialmente dos o más
de los siguientes:
- Indice de masa
corporal (IMC) igual o mayor de 25 kg/m2.
- Relación
abdomino-glútea (RAG) mayor que 0.9 en varones y mayor que 0.85
en mujeres.
- Hipertensión
arterial o tensión arterial mayor que 140/90.
- Existencia de antecedentes
familiares de diabetes (AFD) de primer y/o segundo grado.
- En el caso de mujeres,
antecedentes obstétricos de: hijos macrosómicos (peso
al nacer mayor de 4.0 kg.), fetos con malformaciones congénitas
o abortos a repetición.
 Fase
0 Fase
0
Cada sujeto fue evaluado
de acuerdo a una ficha (Anexo 2). Se le tomó
una muestra de sangre previo ayuno no menor de 12 horas. A continuación
se le administró 75 g de glucosa en 200 ml de solución acuosa,
mezclada con jugo de limón y hielo por vía oral y se le
volvió a tomar muestras de sangre adicionales a los 30, 60, 120
y 180 minutos. En el plasma venoso en ayunas se cuantificó glicemia
e insulinemia, colesterol total, fracción HDL de colesterol y triglicéridos.
En el plasma de las cuatro muestras restantes se dosó glicemia
e insulinemia.
Fase I
A continuación
a cada sujeto se le instruyó para seguir una dieta destinada a
producir un déficit calórico entre 500 y 600 kcal/día
(34) y se le proporcionó aleatoriamente PLACEBO o tabletas de TRIAC
de 35 mg tres veces al día. Tanto el investigador como el sujeto
en estudio desconocieron la composición de las tabletas administradas.
La medicación
fue consumida durante ocho semanas, al cabo de las cuales se volvió
a realizar los mismos exámenes iniciales.
|
|
|
FICHA
|
|
Ensayo
clínico del ácido triyodo - tiroacético
(TRIAC) sobre algunos componentes del Síndrome Metabólico
|
|
1)
DATOS DE FILIACIÓN |
|
|
|
|
2)
HISTORIAS CLÍNICA |
|
|
Antecedentes
Familiares |
|
|
Antecedentes
Personales |
|
|
Enfermedad
Actual |
|
|
|
|
3)
EXAMEN FÍSICO |
|
|
Talla |
|
|
Peso |
|
|
Indice
de Masa Corporal |
|
|
Relación
Adbomino Glútea |
|
|
|
|
4)
Pliegues |
|
|
a)
Sub-escapulares |
|
|
b)
Tricipitales |
|
|
c)
Abdominales |
|
|
|
|
5)
Cabeza |
|
6)
Cuello |
|
7)
Aparato Cardiovascular |
|
8)
Aparato Respiratorio |
|
9)
Abdomen |
|
10)
Genitales |
|
11)
Extremidades Superiores |
|
12)
Extremidades Inferiores |
|
13)
Sistema Nervioso |
|
14)
Columna Vertebral |
|
|
|
|
DIAGNOSTICO |
|
|
|
|
15)
EXAMENES AUILIARES |
|
16)
ENSAYO CLÍNICO |
|
17)
Pérfil Lipídico |
| |
18)
Test de Tolerancia Oral a la Glucosa : |
|
|
Glicemias
e Insulinemias |
|
Fase II
En una etapa final
los mismos sujetos que tomaban TRIAC pasaron a PLACEBO y los que tomaron
PLACEBO pasaron a TRIAC, durante otras ocho semanas más y se les
practicó por tercera vez el mismo grupo de exámenes.
La secuencia de estos
procedimientos día a día fue la siguiente:
Fase 0
Día 000 :Evaluación
clínica y de laboratorio, dieta hipocalórica ajustada
a peso y actividad física. TRIAC 35 mg tres veces al día
durante ocho semanas o PLACEBO.
Fase I
Día 056 :
Re-evaluación clínica, análisis de laboratorio,
continúa con la dieta y pasa a PLACEBO o TRIAC respectivamente
por otras 08 semanas.
Fase II
Día 112 :
Re-evaluación clínica y análisis de Laboratorio.
Sólo 27 de
los 50 sujetos cumplieron con las tres etapas del estudio (Anexo
3).
Metodología
En las muestra de
sangre basales se cuantificó colesterol total, colesterol HDL y
triglicéridos por métodos enzimáticos (35, 36).
La prueba de Tolerancia
a la glucosa se realizó siguiendo las pautas dadas por la OMS (37),
pero se tomó una muestra adicional a los 180'. El dosaje de insulina
se efectuó por un procedimiento de radioinmuno ensayo (38).
La evaluación de las curvas de glicemia y de insulinemia se efectuó
mediante el procedimiento de medición de áreas bajo la curva,
utilizando la fórmula del trapecio (39, 40).
Las características
de los sujetos fueron:
1. La edad promedio
de los varones fue de 58 +- 7.6 años, con un rango de 36 a 73.
2. La edad promedio de las mujeres fue de 51 +- 7.5 años, con un
rango de 29 a 70.
3. El IMC en los varones fue de 31.6 +- 4.0 y el de mujeres de 35.5 +-
2.1.
4. La RAG promedio de los varones fue de 0.99 +- 0.08 y de las mujeres
de 0.91 +- 0.03.
5. La presión arterial registrada fue: Sistólica 125 +-12.5
para varones y 122.6+-6.1 para mujeres y la diastólica 84+-5 para
varones y 82.3 +-4.6 para mujeres.
6. El Colesterol total promedio fue de 199.5 +-22.3 para varones y de
214.6+-17.2 para mujeres (mg/dl).
7. El Colesterol HDL fue de 40+-7.9 para varones y 39.8 +-5.2 para mujeres
(mg/dl).
8. Los Triglicéridos variaron alrededor de 156.3 +- 49.5 para los
varones y 178.0 +- 20 para las mujeres mg/dl.
9. La relación CT/HDL para los varones fue de 5,2 ± 0,9
y para las mujeres de 5,7 ± 0,8.
10.Los valores basales de la relación de áreas bajo la curva
de insulina/glucosa (AREA) fueron 0,53 ± 0,48 para los varones
y 0,69 ± 0,36 para las mujeres.
Metodología
estadística
Se utilizó
primero un análisis descriptivo de las variables más representativas
tales como IMC, RAG, colesterol total, HDL colesterol, triglicéridos,
relación colesterol total/HDL. Para cada una de ellas se calculó
algunos indicadores según genero (Anexos 4 y
5). Se utilizó la prueba estadística no
paramétrica de Wilcoxon. Se seleccionó un conjunto de variables
en relación con el Síndrome Metabólico. Las variables
se detallan a continuación:
- Relación
abdómino-glutea (RAG)
- Indice de masa
corporal (IMC).
- Colesterol total
(ColT)
- Trigliceridos (TG)
- Relación
de áreas bajo la curva de insulina y de glucosa (AREA)
Finalmente se realizó
un análisis multivariado por género de las medidas de las
correlaciones entre las variables elegidas.
|
|
|
INDICADORES
de POSICION y DISPERSION de ALGUNOS FACTORES de RIESGO CARDIOVASCULARES
(GÉNERO MASCULINO)
|
|
Factor
|
No.
Datos
|
Prom.
|
Me
|
Min
|
Max
|
D.E.
|
C.V.
|
I.C.
95%
|
|
IMC1
|
10
|
31.57
|
30.49
|
23.80
|
40.95
|
5.53
|
18
%
|
(27.61-35.53)
|
|
IMC2
|
8
|
28.87
|
28.80
|
23.60
|
38.89
|
4.48
|
16
%
|
(25.11-32.62)
|
|
IMC3
|
10
|
30.01
|
28.38
|
24.00
|
36.90
|
4.61
|
15
%
|
(26.7-33.3)
|
|
RAG1
|
10
|
0.99
|
0.97
|
0.85
|
1.30
|
0.12
|
12
%
|
(0.9-1.07)
|
|
RAG2
|
8
|
0.94
|
0.94
|
0.81
|
1.10
|
0.09
|
10
%
|
(0.86-1.02)
|
|
RAG3
|
9
|
0.94
|
0.94
|
0.85
|
1.03
|
0.06
|
6
%
|
(0.89-0.98)
|
|
Colt1
|
10
|
199.5
|
202.1
|
163
|
247
|
22.31
|
15.6
%
|
(179.7-219.3)
|
|
Colt2
|
10
|
193.6
|
193.6
|
108
|
310
|
52.46
|
27.1
%
|
(160.4-226.8)
|
|
Colt3
|
10
|
207.8
|
209.7
|
140
|
299
|
44.68
|
21.5
%
|
(179.5-236.1)
|
|
TG1
|
10
|
156.30
|
154.00
|
70.00
|
315.00
|
69.24
|
44
%
|
(106.77-205.83)
|
|
TG2
|
10
|
145.70
|
135.50
|
67.00
|
289.00
|
60.95
|
42
%
|
(102.09-189.3)
|
|
TG3
|
10
|
127.40
|
129.50
|
69.00
|
172.00
|
31.84
|
25
%
|
(104.63-150.17)
|
|
AREA1
|
10
|
0.53
|
0.28
|
0.07
|
1.46
|
0.48
|
91
%
|
(0.19-0.88)
|
|
AREA2
|
10
|
0.50
|
0.36
|
0.06
|
1.83
|
0.52
|
104
%
|
(0.14-0.88)
|
|
AREA3
|
10
|
0.54
|
0.52
|
0.04
|
1.39
|
0.40
|
74
%
|
(0.26-0.83)
|
|
|
|
|
INDICADORES
de POSICION y DISPERSION de ALGUNOS FACTORES de RIESGO CARDIOVASCULARES
(GÉNERO FEMENINO)
|
|
Factor
|
No.
Datos
|
Prom.
|
Me
|
Min
|
Max
|
D.E.
|
C.V.
|
I.C.
95%
|
|
IMC1
|
17
|
35.33
|
35.17
|
30.00
|
43.60
|
4.09
|
12
%
|
(33.23-37.43)
|
|
IMC2
|
13
|
34.24
|
34.20
|
28.30
|
42.50
|
4.44
|
13
%
|
(31.58-36.92)
|
|
IMC3
|
13
|
34.38
|
35.00
|
28.00
|
43.60
|
4.37
|
13
%
|
(31.75-37.02)
|
|
RAG1
|
17
|
0.91
|
0.90
|
0.81
|
0.99
|
0.06
|
6
%
|
(0.88-0.94)
|
|
RAG2
|
13
|
0.87
|
0.87
|
0.74
|
0.97
|
0.06
|
7
%
|
(0.83-0.90)
|
|
RAG3
|
13
|
0.87
|
0.88
|
0.74
|
1.00
|
0.08
|
9
%
|
(0.82-0.91)
|
|
Colt1
|
16
|
215.6
|
206.50
|
177.00
|
296.00
|
34.31
|
15.9
%
|
198.45-232.75
|
|
Colt2
|
16
|
196.7
|
193.50
|
148.00
|
248.00
|
33.42
|
17
%
|
179.99-213.41
|
|
Colt3
|
14
|
210.90
|
208.00
|
175.00
|
284.00
|
27.26
|
12.9
%
|
196.33-225.47
|
|
TG1
|
17
|
177.96
|
180.00
|
116.00
|
267.00
|
38.82
|
22
%
|
(158-197.92)
|
|
TG2
|
16
|
177.63
|
160.50
|
91.00
|
312.00
|
59.82
|
34
%
|
(145.75-209.5)
|
|
TG3
|
14
|
166.93
|
189.50
|
65.00
|
247.00
|
59.75
|
36
%
|
(132.43-201.43)
|
|
AREA1
|
17
|
0.69
|
0.65
|
0.24
|
1.56
|
0.36
|
52
%
|
(0.51-0.87)
|
|
AREA2
|
17
|
0.66
|
0.55
|
0.24
|
2.15
|
0.46
|
70
%
|
(0.42-0.89)
|
|
AREA3
|
17
|
0.51
|
0.40
|
0.17
|
1.99
|
0.43
|
84
%
|
(0.28-0.73)
|
|
RESULTADOS
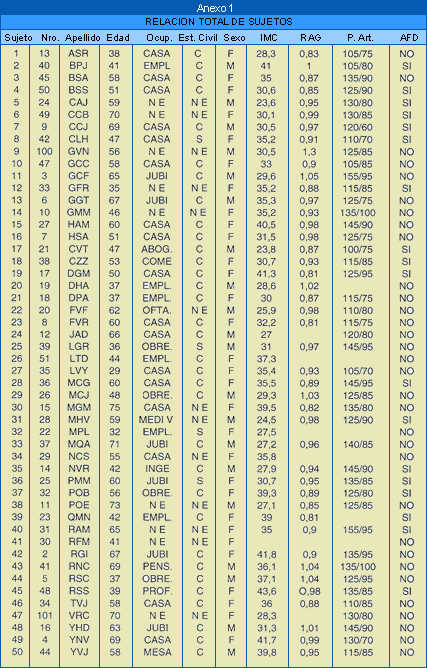
La relación
total de sujetos estudiados aparece en el Anexo 1. Del
total de 50 pacientes solo 27 completaron el estudio: 10 de ellos son
varones y 17 mujeres (Anexo 3).
En los anexo
4 y anexo 5 aparecen los indicadores calculados
de la relación de posición y dispersión de los factores
de riesgo cardiovascular para el género masculino y para el género
femenino.
Con dieta hipocalórica
más TRIAC estos mismos parámetros fueron los siguientes:
[entre parentesis desviacion estandard (DE)].
1. IMC varones 28,87
(DE 4,48) y mujeres 34,24 (DE 4,44)
2. RAG varones
0.94 (DE 0,09) y mujeres 0.87 (DE 0,06)
3. ColT varones
193,7 (DE 52,5) y mujeres 196,7 (DE 33,42)
4. TG varones
145,70 (DE 60,95) y mujeres 177,63 (DE 59,82)
5. AREA varones
0,50 (DE 0,52) y mujeres 0,66 (DE 0,46)
Con dieta hipocalórica
más PLACEBO fueron los siguientes:
1. IMC varones 30,01
(DE 4,61) y mujeres 34.438 (DE 4,37)
2. RAG varones
0.94 (DE 0.06) y mujeres 0.87 (DE 0,08)
3. ColT varones
207,8 (DE 44,7) y mujeres 210,9 (DE 27,26)
4. TG varones
127,40 (DE 31,84) y mujeres 166,93 (DE 59,75)
5. AREA varones
0,54 (DE 0,40) y mujeres 0,51 (DE 0,43)
Los cuadros completos
de los INDICADORES DE POSICIÓN Y DISPERSION DE LOS FACTORES DE
RIESGO CARDIOVASCULAR arriba mencionados aparecen en los anexos
4 y anexo 5. Cada sujeto sirvió como su propio
control ya que pasó por las tres etapas: condición basal,
dieta hipocalórica más TRIAC y dieta hipocalórica
mas PLACEBO. TRIAC y PLACEBO fueron administrados en forma aleatoria,
de manera que hubo un grupo de enfermos que recibieron inicialmente TRIAC
y después PLACEBO mientras que en el resto la secuencia fue inversa.
De acuerdo a los
resultados obtenidos podemos deducir lo siguiente:
- Existe evidencia
estadística para afirmar que el IMC disminuye significativamente
(p < 0,05) en varones.
- En mujeres el IMC
tiene tendencia a disminuir pero sin alcanzar significado estadístico.
- Existe evidencia
estadística para afirmar que tanto en varones como en mujeres
la RAG disminuye en forma significativa (p < 0,05). Llama la atención
que tanto en varones como en mujeres este efecto se prolonga hasta la
etapa de PLACEBO.
- Existe evidencia
estadística para afirmar que el colesterol total (ColT) disminuye
bajo la acción de TRIAC en forma significativa en las mujeres
(p < 0,05).
- En los varones
existe la misma tendencia pero sin llegar a niveles significativos.
- Existe evidencia
estadística para afirmar que los triglicéridos (TG) disminuyen
en forma significativa (p < 0,05) en varones. En ellos el efecto
se prolonga hasta la etapa de PLACEBO.
- En las mujeres
este efecto es no significativo, pero se hace mas manifiesto en la etapa
de PLACEBO.
- La relación
de áreas insulina/glucosa (AREA) disminuye en forma significativa
(p < 0,05) tanto en varones como en mujeres. En estas últimas
el efecto se prolonga hasta la etapa PLACEBO.
DISCUSIÓN DE LOS RESULTADOS
En nuestro conocimiento
no existe en la literatura a nuestro alcance ningún estudio sobre
la posible influencia de TRIAC en los componentes del "sindrome metabolico"
según su definición de trabajo" de Alberti y Zimmet
(1).
Hemos incluido en
este estudio sujetos portadores de obesidad central o abdominal (n = 26).
También fue incluido un paciente (CVT) con antecedentes familiares
de DM2. En 25 casos hubo dislipidemia caracterizada por una o más
de las siguientes condiciones: hipertrigliceridemia (n = 19), hipercolesterolemia
(n = 16) y cHDL bajo (n = 14). Los otros dos fueron un varón con
DM franca, pero con glicemia en ayunas normal (CCJ) y una mujer con antecedentes
de hijos macrosómicos (más 4,0 kg a nacer) (HSA).
Este fue un estudio
doble ciego y cruzado. Alrededor de 50% de los casos recibieron dieta
hipocalorica más TRIAC y el resto dieta más PLACEBO. Al
cabo de ocho semanas los primeros reemplazaron el TRIAC por PLACEBO y
los restantes recibieron TRIAC en lugar de PLACEBO. Dieta sola (dieta
más PLACEBO), dependiendo de la adherencia del paciente a ella,
puede otorgar beneficios. Si se agrega en un paso posterior TRIAC, estos
beneficios aumentarán. En el caso inverso, dieta más TRIAC,
ofrecerá desde el inicio los máximos y el paso a dieta más
PLACEBO teóricamente influirá muy poco en el resultado final.
Sin embargo, actualmente se acepta que TRIAC es un análogo natural
de T3. Al igual que T3 su análogo TRIAC desarrolla acciones genómicas
uniéndose a su receptor (TR) y regulando su efecto genético
con ayuda de "elementos de respuesta a T3" (TREs). Este es un
mecanismo de inicio lento pero de efecto prolongado (41). Se ha comprobado
que TRIAC tiene efectos similares a T3 a nivel hepático tanto en
ratas (42) como en humanos (43). Igualmente TRIAC posee actividad antioxidante
de LDL humana (44). De conformidad con estos conocimientos TRIAC podría
prolongar su acción hasta momentos en que ya no es administrada.
Sin embargo, en este momento todavía no estamos en condiciones
de afirmar o negar estas suposiciones.
Los resultados de
este estudio demuestran que TRIAC tiene efectos beneficiosos especificamente
sobre la relación abdómino-glútea (RAG) y sobre la
relación de áreas bajo la curva insulina/glucosa. RAG, vale
decir obesidad central o abdominal, disminuye significativamente y aparentemente
este efecto se mantiene en la etapa de PLACEBO. La relación de
áreas (AREA) y también mejora significativamente y ello
implica disminución de la resistencia a la insulina. A ellos debemos
agregar la mejoría significativa del IMC y de los triglicéridos
en varones lo mismo que el colesterol en mujeres.
BIBLIOGRAFÍA
1. Alberti, KGMM.
and Zimmet, P. Definition, diagnosis and classification of diabetes
mellitus and its complications. Part 1: Diagnosis and classification of
diabetes mellitus. Provisional report of a WHO consultation. Diabetic
Med. 1998; 15: 5 39.
2. Zubiate, M. Síndrome X. En: Calderón R y Peñaloza
JB: Diabetes Mellitus en el Perú 1996. Capítulo 20.
3. Kaplan, NM. The deadly quartel: upperbody obesity, glucose intolerance,
hypertriglyceridemia and hypertension. Arch Int Med 1989; 149: 1514.
4. Reaven, GM. Role of insulin resistance in human disease. Diabetes
1988; 371595.
5. Zimmet, P. Challenges in diabetes epidemiology - from West to
the rest. Diabetes Care 1992; 15: 232.
6. Zimmet, P. Epidemiology as a tool for diabetes research and
care. Diabetología 1999; 42: 499.
7. Zimmet, P. The Epidemiology and Primary prevention of non-insulin
dependent diabetes mellitus. Diabetes in pictures 1997. Hoechst Marion
Roussel.
8. Zubiate, M. Hiperlipemia postprandial. Libro de resúmenes
IV Congreso Latinoamericano - 4to. Congreso Argentino. FLASO. Buenos Aires,
Argentina. 1999:116 -117.
9. Zimmet, P. Hyperinsulinemia - How innocent a bystander? Diabetes
Care 1993 ; (Suppl 3): 56.
10. Obesity. Preventing and managing the global epidemic. Report
of a WHO Consultation on Obesity. WHO 1998.
11. Lean, M. Clinical Handbook of Weight Management.1998; Martin
Dunitz Ltda.
12. Moreno, B; Monereo, S. y Alvarez, J. Obesidad 1997. Grupo Aula
Medica. Cap.10. Aspectos Clínicos de la Obesidad.
13. Bray, GA . Health hazards of obesity. In: Endocrinol Metabol
Clin NA. 1996; 25: 907.
14. Ryan, DH. Medicating the obese patient. In Id.
15. Gross, J. and Pitt-Rivers, R. The identification of 3,5,3'-L-triiodothyronine
in human plasma. Lancet 1952; 1: 439.
16. Nakamura, Y. et al. An assesment of the concentration of acetic
acid and propionic acid derivates of 3,5,3'-triyodothyronine in human
serum. J Clin Endocrinol Metabol 1978; 46: 91.
17. Burger, A. and Valloton, MB. The metabolism of tetraiodothyroacetic
acid and its conversion to triiodothyroacetic acid in man. In: Harland
WA, Orr Js (eds): Proceedings of the International conference of thyroid
hormone metabolism. Academic Press London 1975: 223.
18. Singer, PA. Evaluation of thyroid function. In: Lavin N: Manual
of endocrinology and metabolism 1994. Little, Brown and Co (Second Edition:
343).
19. Burger, A. and Valloton, MB. The metabolism of 125 1-3,5,3'
- triiodothyroaceticacid and its conversion to tetraiodothyroacetic acetic
acid. In: Robbins J, Braverman LE (eds) Thyroid Research 1976. American
Elsevier New York.
20. Goslins, B. et al. Comparison of the metabolism and distribution
of L-triiodothyronine and triiodothyroacetic acid in the rat. A possible
explanation of the differential hormonal potency. Endocrinol 1976; 98
: 666.
21. Arnal, J. and Bourquin, C. A propos du traitement de l'obesité.
Información actual sobre TRIAC. Extrait e Sem Hop Paris (Ther)
1976; 52 (2): 99.
22. Andrada, JA. et al. Accion del TRIAC sobre los hidratos de
carbono y lípidos sanguíneos. Medicina Vol XXIV 1 1964 (Buenos
Aires).
23. Arnal, J. and Chicouri, M. A propos de 500 cas de surcharges
ponderales traites per le Triacana comprimés. Extrait de la Gzette
Medicale de France 1978; 85: 2682.
24. Hachem, A. and Bourgoin, JY. le role du TRIAC dans le traitement
de l'obesite. Extrait de la Gazette Medicale de France 1979 ; 86 : 2835.
25. Adenyl - Jones, SK. et al. Clinical Research 1979; 86: 2835.
26. Vague, J. et al. Deltoid-trochanter ratio of number and volume
of adipocytes in diabetic and non-diabetic obese subjects. Diabetologia
1974: 10.
27. Benjamou, D. Aspects actuels du traitement des surcharges ponderales
et de l'obesité. Extrait d'AMIF 1979 ; vol 27; 274, mars.
28. Michel, R. et al. Hormones thyroidiennes et metabolism du cholesterol
chez le pouliet. I. Action des hormones et de leurs derivés et
atherome expérimental. Acta Endocrinol 1969; 34: 558.
29. Sherman, Si. and Ladenson, PW. Organ specific effects os tiratricol:
A thyroid hormone analog with hepatic, not pituitary, superagonist effects.J
Clin Endocrinol Metab 1992; 75: 901.
30. Davis, PJ. and Davis, FB. Nongenomic actions of thyroid hormone.
Thyroid 1996; 6: 497.
31. Brent, GA. The molecular basis of thyroid hormone action. N
Engl J Med 1994; 331: 847.
32. Lazar, MA. Thyroid hormone receptors: Multiple forms, multiple
possibilities. Endocr Rev 1993; 14:184.
33. Motomura, K. and Brent, GA. Mechanisms of thyroid hormone action.
Endocrinol Metabol Clin N A 1998; 27:1-23.
34. Coffee, CJ. Metabolism 1998. Chapter 5: Nutrition and Metabolism.
Fence Creek publishing. LLC, Madison, Connecticut.
35. Joint National Committee on Detection, Evaluation and Treatment
of High Blood Pressure (5th Report) Arch Intern Med 1993; 1534:154.
36. Tietz, L. (Edit): Fundamentals of clinical chemistry. WB Saunders
1976.
37. The expert Committee in the diagnosis and Classification of Diabetes
Mellitus. Report of the Expert Committee on the Diagnosis and Classification
of Diabetes Mellitus. Diabetes Care 1997; 20: 1183-97.
38. RIA - DPC (Diagnosis Products Corporation - USA).
39.Carlsen, SM. et al. Evidence for dissociation of insulin-and
weight-reducing effects of metformin in non-diabetic male patients with
coronary heart disease. Diabetes Research Clin. Practice 1998; 39: 47.
40. Reaven, GM. and Miller R: Study of the relationship between
glucose and insulin response to an oral glucose load in man. Diabetes
1968; 17: 560.
41. Beck-Peccoz, P. et al. Dissociated thyromimetic effects of
5,5,3' triiodothyroacetic acid (Triac) at the pituitary and peripheral
tissue levels. J Endocrinol Invest 1988;11:113.
42. Messier, N. and Langlois, MF. Triac regulation of transcription
is T3 receptor isoform - and response element-specific. Molecul Cellular
Endocrinol 2000; 165:57.
43. Chomard, P. Seguin, C; Loireau, A; Autissier, N. and Artur, Y.
Effects of iodotyrosines, thyronines, iodothyroacetic acids and thyromimetic
analogues on in vitro copper-induced oxidation of low-density lipoproteins.
Biochem Pharmacol 1998 May 15; 55 (10):1591-601.
44. Liang, H; Juge-Aubry, CE; O'Connell, M. and Burger, AG. Organ-specific
effects of 3,5,3'-triiodothyroactic acid in rats: Eur J Endocrinol 1997
Nov;137 (5): 537 - 44.
(*) Asesor de EsSalud (HNGAI)
|
