Hepatitis A y E
Martín Tagle A. (1)
Introducción
Se describieron por primera vez brotes de epidemias de hepatitis ictérica en Europa en los siglos 17 y 18 (1). La dife-renciación epidemiológica entre la hepatitis A (hepatitis “infecciosa”) y la hepatitis B (“hepatitis del suero”) provino de estudios realizados en las tropas provenientes de la Segunda Guerra Mundial (2). El virus de hepatitis A fue aislado por primera vez en 1979. El objetivo de este artículo es el de revisar los aspectos epidemiológicos, clínicos y de prevención más relevantes para el clínico y el médico general, revisando tam-bién la literatura publicada en nuestro medio.
Etiología
El virus de la hepatitis A (HAV) pertenece a la familia de los Picornavirus, que incluye a los enterovirus y a los rinovirus. Es un virus de cadena RNA simple que mide aproxi-madamente 28 nm (3). Es relativamente termoestable y es inactivado por autoclave, radiación ultravioleta, formol y yodo. También puede ser destruído al hervir el agua por 5 minutos, pero puede persistir en algunos mariscos (4).
Epidemología
El virus es encontrado en altas concentraciones en heces de personas infectadas, siendo la principal vía de transmisión la fecal-oral. El contacto de persona a persona dentro de un núcleo familiar sigue siendo uno de los principales mecanismos de transmisión del virus. La transmisión por comida o agua puede ocurrir cuando hay contaminación con HAV y es ingerido por una persona susceptible. Algunos de los vehículos involucrados en las epidemias de HAV incluyen comida cruda o parcialmente cocida, ensaladas y hambur-guesas. Se reportó recientemente una epidemia de hepatitis A en más de 500 personas en los Estados Unidos, asociada a consumo de cebolla china (5). Hubo tres muertes por falla hepática fulminante. El virus de hepatitis A es altamente endémico en los países en vías de desarrollo, donde la mayoría de las personas adquieren la infección tempranamente (6). En algunas partes del mundo como Europa del este, Unión Soviética y partes del Asia, algunos niños se escapan de la infección durante la niñez y se puede ver un aumento paradójico de tasas de hepatitis A en adultos. En los años 1980s se observó un aumento en el número de usuarios de drogas endovenosas con hepatitis A en los Estados Unidos, y este incremento llegó a su pico en 1986 cuando un 19% de los casos de hepatitis A se asociaron a éste tipo de prácticas (7). En 1991 hubo un marcado aumento de los casos de hepatitis A reportados entre homosexuales en Estados Unidos, Canadá y Australia, probablemente secundario a prácticas sexuales poco seguras como el contacto oral-anal (8-10). Se han descrito epidemias de hepatitis A en personal de salud que trabaja en unidad de quemados (11) y en unidades de cuidados intensivos neonatales (12). La transmisión por transfusión de sangre es muy rara pero donantes en fase prodrómica han demostrado ser capaces de transmitir el virus por esta vía (13). En países en desarrollo la enfermedad suele ser hiperendémica y la mayoría de infecciones ocurren en la niñez. En nuestro país, Vildósola y col. (14) realizaron un estudio evaluando la presencia de anticuerpos IgG contra en virus de la hepatitis A en 859 individuos de Lima metropolitana entre 1 y 39 años. En la población mayor de 20 años de edad, encontraron una prevalencia de anticuerpos de 84% mientras que en niños de 14 años y menores la prevalencia fue del 46.3%. Cuando dividieron a la población estudiada en estratos socio-económicos, en el estrato socioeconómico CD la prevalencia fue de 54.8% y en el AB de 42.8%, cifras menores que las reportadas una década anterior, hecho probablemente atribuíble a la mejoría de las condiciones sanitarias de cierto segmento de la población. Sin embargo esto también traduce una mayor población susceptible a adquirir la infección aguda en la edad adulta en Lima metropolitana, resaltando entonces la importancia de la vacunación en adultos y niños.
Cuadro clínico
La hepatitis A es con frecuencia una infección asintomática, usualmente con curso anictérico especialmente en niños. La probabilidad de presentar síntomas está en relación a la edad de la persona. En niños menores de 6 años, el 70% hacen infecciones asintomáticas o en todo caso anictéricas. En niños mayores y adultos la infección es ictérica en el 70% de los pacientes (15). La mayoría de casos ocurre entre 2 y 6 semanas después de la exposición al virus (período de incubación). El virus ha sido documentado en heces 2 a 3 semanas antes del desarrollo de síntomas. El curso clínico es usualmente benigno, comenzando con un pródromo entre 1 y 7 días antes del inicio de la coluria en los casos ictéricos. Puede haber síntomas tipo catarral, fiebre, malestar general, hiporexia y náusea inducida por comidas grasosas o tabaco. Muchos de los pacientes acuden a la consulta médica cuando notan coluria que es asociada a veces con hipocolia e ictericia. En el exámen físico se nota hepatomegalia dolorosa y esplenomegalia en 15% de casos. En una proporción significativa de pacientes la aparición de ictericia se asocial a resolución rápida de los síntomas. La duración de la enfermedad es variable pero suele durar tres semanas. Los niños pueden excretar virus de hepatitis A por períodos más largos que los adultos, incluso meses despues de la enfermedad clínica (16). La hepatitis A en ocasiones puede tener un curso prolongado, y en algunos casos la ictericia puede durar 12 a 18 semanas, con prurito marcado y fiebre (hepatitis colestásica) pero la recuperación es la regla y no hay secuelas crónicas en el hígado (17). La recurrencia puede ocurrir, carac- terizada por exacerbaciones de síntomas y elevación de aminotransferasas semanas a meses luego de la recuperación de la enfermedad aguda. La recuperación tambien ocurre siempre en estos casos (18). No existe excreción crónica de HAV en heces, pero sí puede ocurrir en personas que tienen cursos recurrentes (19). Las manifestaciones extrahepáticas de la hepatitis A son poco comunes. Se ha reportado vasculitis cutánea con depósitos de IgM, crioglobulinemia, colecistitis, así como síndromes neurológicos como Guillain Barré, mielopatías, mononeuritis, meningoencefalitis o exacerbaciones de esclerosis múltiple pre existente (20-23). Nosotros describimos el caso de un paciente varón de 42 años con recurrencia de hepatitis A quien presentó falla renal severa requiriendo hemodiálisis, finalmente recuperando ad integrum sus funciones renal y hepática (24). La hepatitis A también puede actuar como factor desencadenante para hepatitis autoinmune, que debe sospecharse en pacientes con niveles de aminotransferasas persistentemente elevados luego de la resolución de la fase ictérica (25). La edad al momento del diagnóstico es también un factor determinante del pronóstico. La infección en mayores de 50 años tiene más probabilidades de asociarse a curso fulminante (26). Aunque no se encuentren en mayor riesgo para contraer hepatitis A, los pacientes con enfermedad hepática crónica de cualquier etiología están en mayor riesgo de hacer cursos tórpidos cuando adquieren hepatitis A (27).
Diagnóstico
La elevación de niveles de aminotransferasas (AST, ALT) es un marcador sensible pero no específico para daño parenquimal hepático. Sin embargo no hay correlación entre la severidad clínica y el grado de transaminasemia. La prolongación del tiempo de protrombina (INR) es un signo de severidad, especialmente si se asocia a cambios en el estado mental. En formas colestásicas puede verse elevación más significativa de fosfatasa alcalina. El diagnóstico serológico require de la medición de Inmunoglobulina M contra las proteínas de cápside del virus (IgM anti HAV), que está usualmente presente durante la fase aguda de la enfermedad, disminuyendo progresivamente hasta desaparecer en 3 a 6 meses (Figura 1). Los anticuerpos IgG anti-HAV son detec- tables durante la fase aguda, llegando a títulos altos en la convalecencia, persistiendo de por vida y confiriendo inmunidad permanente. La detección del RNA viral (HAV RNA) en heces es posible durante la fase aguda de la infección en la mayoría de las personas, usando métodos sofisticados de amplificación de ácidos nucleicos, pero son pruebas disponibles sólo en laboratorios de investigación y no se utilizan en la práctica clínica con propósitos diagnósticos (28).
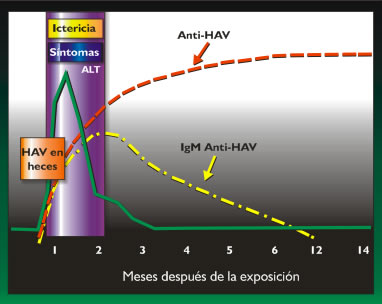 |
| Figura 1. Secuencia de eventos en hepatitis A. |
Tratamiento
No existe terapia específica para la infección por hepatitis A y el manejo es esencialmente de soporte. La identificación de pacientes que requieran transplante hepático es crítica cuando hay desarrollo de encefalopatía hepática, aunque aún en casos fulminantes se ve recuperación espontánea más frecuentemente que en hepatitis B. Con la selección cuidadosa, la tasa de sobrevida para hepatitis A fulminante con transplante hepático es del 80% (29). En casos no complicados no hay indicación para admisión al hospital y no hay evidencia en la literatura que sustente que el reposo prolongado en cama ó restricciones dietéticas afecten favorablemente el curso clínico. El reposo relativo durante la fase prodrómica y de malestar general, una alimentación balanceada y el evitar alcohol o medicamentos hepatotóxicos son reglas recomendables. El uso de productos vitamínicos variados comercializados como “hepatoprotectores” tampoco ha demostrado ser necesario en el manejo de estos pacientes.
Profilaxis
Las buenas prácticas de higiene y la restricción de actividades de las personas enfermas que trabajan en la industria alimentaria son fundamentales. Los viajeros a áreas endémicas deben ser aconsejados de no ingerir comida mal cocida con énfasis especial en vegetales y mariscos. La inmunoglobulina confiere protección contra la hepatitis A a traves de la transferencia pasiva de anticuerpos (inmunización pasiva). Se utiliza la preparación intramuscular cuyas únicas indicaciones son: inmunoprofilaxis pre-exposición en viajeros a áreas endémicas (idealmente dos semanas antes del viaje), para personas que han ingerido alimentos manipulados por un paciente con hepatitis A aguda o para contactos intrado- miciliarios ó sexuales de pacientes con hepatitis A (30). No se cuenta con dicho producto en nuestro medio. Los niveles séricos de anticuerpos neutralizantes persisten por aproximadamente 18 semanas. Cuando se utiliza para profilaxis pre exposición se administra una dosis de 0.02 ml/Kg intramuscular, confiriendo protección por menos de 3 meses. Cuando se administra dentro de las dos semanas post-exposición a hepatitis A a las dosis señaladas, la eficacia protectora es del 85% (31). La eficacia es mayor cuando la inmu-noglobulina es administrada temprano en el período de incubación. Cuando es administrada más tardíamente, sólo atenúa los síntomas de la hepatitis aguda. No se recomienda su utilización en personas que son contactos casuales de los pacientes (colegio o trabajo). No se ha reportado transmisión de hepatitis B, VIH, hepatitis C u otros virus con la gammaglobuli-na hiperinmune.
En Febrero de 1995 se licenció en los Estados Unidos una vacuna de virus inactivado (Havrix), para uso en personas de más de dos años de edad (32). La vacuna no está aprobada para uso en niños menores de dos años por la preocupación de que los niños que pueden haber adquirido anticuerpos de la madre podrían tener una respuesta menor a la vacuna (33). Se recomienda también para viajeros a áreas endémicas y otros grupos de riesgo. Cada ml de vacuna para adultos contiene 1440 Unidades ELISA de antígeno viral. La dosis recomendada para adultos es de 1 ml intramuscular en el deltoides, y un refuerzo de 1 ml 6 a 12 meses más tarde (30). Los niveles de protección se detectan en adultos en un 80 a 98% dos semanas despues de la primera dosis y 96% después de un mes (34). Existen otras presentaciones comerciales de vacuna inactivada de hepatitis A que se encuentran disponibles en nuestro medio, con eficacia equivalente. Ambas vacunas son altamente inmunogénicas en personas adultas. Luego la segunda dosis, prácticamente todas las personas tienen niveles protectores de anticuerpos. Sin embargo algunos estudios muestran una menor concentración de anticuerpos en pacientes con VIH (35). Entre los varones VIH positivos, los que respondieron a la vacuna tenían un mayor conteo de linfocitos CD4 comparado a los que no respondieron. Los estimados de la presencia de anticuerpos provenientes de estudios de cinética de anticuerpos sugieren que los niveles protectores deberían durar por lo menos 20 años (36). La política de inmunización tiene que ser individualizada tomando en cuenta la prevalencia de la infección en la población del sujeto. Independientemente de la endemicidad, los siguientes grupos deberían ser vacunados: pacientes con enfermedades hepáticas crónicas, manipuladores de alimentos, trabajadores de centros de cuidado de bebés o pacientes institucionalizados (ancianos, pacientes con retardo mental). La medición de anticuerpos anti-HAV previo a la vacunación podría ser una medida costo-efectiva en zonas de endemicidad alta o intermedia, considerando que el costo de la prueba es menor que el de las dos dosis de vacuna. En nuestro medio debe prestarse especial atención a los hallazgos del estudio de Vildósola y col. (14) que ilustra la presencia importante de adolescentes y adultos susceptibles a adquirir la infección, siendo recomendable investigar el estado inmune contra hepatitis A de las personas, especialmente de aquellas que viajan a zonas rurales.
En Mayo del 2001, la FDA aprobó una vacuna combinada para hepatitis A y B (Twinrix) para personas mayores de 18 años (37). Los componentes antigénicos de dicha vacuna han sido utilizados como vacunas separadas durante muchos años como vacunas de hepatitis A y B respectivamente, y su eficacia como producto combinado es comparable a los productos individuales.
HEPATITIS E
Introducción
La hepatitis E es una forma entericamente transmitida de hepatitis viral que es más común en zonas tropicales y sub tropicales, habiéndose reportado epidemias en Asia, África, el Medio Este y Centro América. Se ha asociado a enfermedad hepática fulminante especialmente en gestantes del tercer trimester, pero al igual que ocurre con la hepatitis A, no se ha descrito hasta el momento secuelas crónicas. El primer reporte documentado de epidemia de hepatitis no-A no-B transmitido entéricamente provino de la India en 1955. Cuando se hizo un estudio retrospectivo 25 años más tarde, todos los sueros almacenados tenían IgG anti HAV pero no IgM anti HAV, demostrando que el agente etiológico de dicha hepatitis viral no fue hepatitis A (38). Posteriormente se reportaron otros brotes asociados con alta mortalidad en gestantes del sudeste asiático (39). En 1990 se clonó el virus de hepatitis E (VHE) por primera vez permitiéndose el desarrollo de pruebas diagnósticas específicas (40).
Etiología
El VHE no ha sido clasificado aún. Se han identificado partículas en microscopio electrónico que miden alrededor de 32 nm, esféricas, sin envoltura, que se asemejan a los Calicivirus. Es desintegrado con la exposicón al cloruro de cesio y a - 20 o C (41). El genoma es de tipo RNA y mide aproximadamente 7.5 kilo bases. Se han identificado ocho diferentes genotipos hasta la fecha: Burma (tipo 1) Mejicano (tipo 2) Norteamericano (tipo 3), Chino (tipo 4), Europeo (tipo 5, 6 y 7) , Argentino (tipo 8) (42) y el más recientemente descrito, el austríaco (43). Sin embargo, pese a diferencias en genotipos hay un solo serotipo que explica la reacción cruzada entre diferentes determinantes antigénicos principales, y es el que permite el diagnóstico serológico. Las partículas de VHE aparecen en las heces durante el período prodrómico, pudiendo asociarse a fase virémica. Varias semanas luego de la exposición, el antígeno aparece en la sangre y los anticuerpos se desarrollan 1 mes más tarde, coincidiendo con el pico de transaminasas.
Epidemología
La hepatitis E ha sido implicada en cerca del 50% de casos esporádicos de hepatitis viral aguda en países en desarrollo (44). Si bien Norteamérica y Europa han sido consideradas zonas no endémicas, la seroprevalencia varía entre el 1 al 5% (45). Clemente-Casares y col. (46) analizaron el virus excretado en los desagües de zonas urbanas de Barcelona y otros países como Estados Unidos, Grecia, Francia y Suecia. El 84% de las muestras de dichas aguas tuvieron RNA de hepatitis E (HEV RNA). Una de cada 5 muestras de Washington y una de cada 4 muestras de Francia fueron positivas. No se detectó ninguna muestra positiva en Grecia o Suecia. Estos datos sugieren que las cepas de hepatitis E están más difundidas de lo que se pensaba en países desarrollados. Los ataques de hepatitis E se describen especialmente en adultos y es raro verlos en niños menores de 15 años (44), en contraste con la infección por hepatitis A que es un evento más raro en adultos. En Egipto la serprevalencia de hepatitis E en un estudio, excedió el 60% en la primera década de la vida, llegó a un pico de 76% en la segunda década y se mantuvo encima del 60% hasta la octava década (47). Esta es la más alta prevalencia reportada en el mundo para hepatitis E. Se documentó seroconversion a anti-HEV en 4 de 211 viajeros de los Estados Unidos hacia Tailandia, Rusia, China y Perú (48), pero ninguno de ellos desarrolló síntomas. Esto implica que la exposición al virus resultó en infecciones subclínicas.
Se ha sugerido la presencia de reservorios animales en algunas regiones y que las infeccones en humanos pueden ser una zoonosis. El VHE ha sido aislado en 22% de muestras de heces en 115 granjas porcinas en Holanda (49). Noventa por ciento de ratas salvajes en Hawai, 77% de Maryland (Estados Unidos) y 44% en Louisiana (Estados Unidos) fueron seropositivas para VHE (50). En Vietnam, donde la hepatitis E es endémica, se ha detectado anti VHE en 44% de pollos, 36% de cerdos, 27% de perros y 9% de ratas (51). Se estudió veterinarios que tienen contacto con cerdos en 8 distintos estados de los Estados Unidos determinándose que tenían 1.5 veces más probabilidad de ser anti-VHE positivos que donantes de sangre normales (52). En nuestro país Vildósola y col. (53) estudiaron a 191 varones trabajadores de la empresa de servicio de agua potable y alcantarillado de Lima, detectando anti - VHE en 10.9% de ellos. El único factor de riesgo en dicho trabajo es el tiempo de trabajo de la persona expuesta, entre 13 y 20 años. Este es el único trabajo publicado en el Perú documentando de alguna manera la presencia de anticuerpos contra dicho virus. No hay hasta el momento reporte de casos agudos en nuestro medio. La transmisión de persona a persona es una ruta potencial de infección, como lo sugiere el patrón epidemiológico descrito en un epidemia en México (54). Las mujeres en el tercer trimestre de gestación están en muy alto riesgo de desarrollar hepatitis fulminante (39), y esta es tal vez la característica epidemiológica más prominente de esta enfermedad. Existe también la posibilidad de transmisión parenteral como lo documenta un estudio (55).
Cuadro clínico
El período de incubación de la hepatitis E es de aproximadamente 40 días. Es una enfermedad autolimitada y no puede ser distinguida de otras hepatitis virales basándonos sólo en características clínicas. Sin embargo, se debe sospechar en cualquier persona con hepatitis aguda con historia de viaje reciente a zonas endémicas y serología negativa para hepatitis A, B y C. Puede haber fiebre, artralgias, malestar general y náuseas. Como se ha mencionado, no hay hasta el momento casos documentados de cronicidad por hepatitis E.
La mortalidad en gestantes del tercer trimestre es de alrededor del 20% (56). En una epidemia en Argelia todas las 9 mujeres gestantes infectadas fallecieron por hepatitis fulmi-nante (56). Esta predilección por las formas fulminantes en gestantes no se ve en otras formas de hepatitis, y no hay una explicacion patofisiológica clara para este catastrófico evento.
Diagnóstico
Recientemente se ha desarrollado un método sensible y específico (Western Blot) capaz de detectar anti-VHE en sueros agudos y convalescientes (57). Tambien hay variantes del método ELISA que han demostrado ser igualmente eficaces (58) tanto para IgG (convalecencia) como para IgM (casos agudos). La técnica PCR ha sido utilizada para detectar VHE en heces de pacientes infectados agudamente, pero es aún considerada experimental (59). En 1995 un grupo de misioneros de las Naciones Unidas fueron detectados por éste método, permi-tiendo el control de la infección dentro del grupo y evitando la diseminación de la enfermedad (60).
Tratamiento
No hay actualmente ningún tratamiento efectivo para la infección por hepatitis E además de las medidas de soporte generales, como describimos en la sección correspondiente de hepatitis A.
Profilaxis
Hervir el agua antes beberla durante las epidemias de hepatitis E ha demostrado reducir la transmisión de la enfermedad (54). Los viajeros a zonas endémicas, y especial-mente las mujeres gestantes en el último trimestre deben evitar comida no cocida y beber agua potencialmente contaminada. Las preparaciones de inmunoglobulinas no son protectores, aún cuando provienen de sueros de personas de áreas endémicas (44).
Está en desarrollo una vacuna para hepatitis E y algunos estudios animales son promisorios (61), aunque en el momento actual no se cuenta con una vacuna efectiva en humanos.
Bibliografía
- Gust ID, Ruff TA. Hepatitis in the tropics. Med J Aust 1993;159:691.
- Purcell RH. Hepatitis viruses: changing patterns of human disease. Proc Natl Acad Sci 1994;91:2401.
- Miller RH. Comparative molecular biology of the hepatitis viruses. Sem Liv Dis 1991;11:113.
- Koff RS, Sear HS. Internal temperature of steamed clams. N Eng J Med 1967;276:737.
- Center for Disease Control. Hepatitis A Outbreak Associated with Green Onions at a restaurant - Monaca, Pensylvania, 2003. MMWR 2003;52:1155.
- Craig AS, Schaffner W. Prevention of hepatitis A with the hepatitis A vaccine. N Engl J Med 2004;350:476.
- Alter MJ, Mast EE. The epidemiology of viral hepatitis in the United States. Gastroenterol Clin N Am 1994;23:437.
- Center for Disease Control. Hepatitis A among homosexual men- United States, Canada, and Australia. MMWR 1992;41:155.
- Villano SA, Nelson KE, Vlahov D et al. Hepatitis A among homosexual men and injection drug usersá: more evidence for vaccination. Clin Infec Dis 1997;25:726.
- 0Katz MH, Hsu L, Wong E et al. Seroprevalence of and risk factors for hepatitis A infection among young, 1997.
- Doebbeling BN, Li N, Wenzel RP. An outbreak of hepatitis A among health care workers: risk factors for transmission. Am J Public Health 1993;83:1679.
- Rosenblum LS, Villarino ME, Nainan OV et al: Hepatitis A outbreak in a neonatal intensive care unit: risk factors for transmission and evidence of prolonged viral excretion among preterm infants. J Infect Dis 1991;164:476.
- Soucie JM, Robertson BH, Bell BP et al. Hepatitis A virus infections associated with clotting factor concentrate in the United States. Transfusion 1998;38:573.
- Vildósola H, Colichón A, Rubio MP y col. Prevalencia de anticuerpos contra hepatitis A (anti HAV IgG) en una población de 1 a 39 años de Lima. Rev Gastroenterologia del Perú 2000;20(2).
- Bell BP, Shapiro CN, Alter MJ et al. The diverse patterns of hepatitis A epidemiology in the United States. Implications for vaccination strategies. J Infect Dis 1998;178:1579.
- Skinj JP, Mathiesen LR, Kryger P et al. Faecal excretion of hepatitis A virus in patients with symptomatic hepatitis A infection. Scand J Gastroenterol 1981;16:1057.
- Gordon SC, Reddy KR, Schiff L et al. Prolonged intrahepatic cholestasis secondary to acute hepatitis A. Ann Int Med 1984;101:635.
- Lesnicar G. A prospective study of viral hepatitis A and the question of chronicity. Hepatogastroenterology 1988;35:69.
- Sjogren MH, Tanno H, Fay O et al. Hepatitis A virus in stool during relapse. Ann Intern Med 1987;106:221.
- Dan M, Yaniv R. Cholestatic hepatitis, cutaneous vasculitis, and vascular deposits of immunoglobulin M and complement associated with hepatitis A virus infection. Am J Med 1990;89:103.
- Ilan Y, Hillman M, Oren R et al: Vasculitis and cryoglobuli-nemia associated with persistent cholestatic hepatitis A virus infection. Am J Gastroenterol 1990;85:586.
- Mourani S, Dobbs SM, Genta RM et al: Hepatitis A virus-associated cholescystitis. Ann Int Med 1994;120:398.
- Tabor E, Guillain-Barre. Syndrome and other neurologic.
syndromes in hepatitis A, B and non-A, non-B. J Med Virol 1987;21:207. - Tagle M, Barriga J, Gutiérrez S y col. Hepatitis viral tipo A recurrente complicada con Insuficiencia Renal. Rev Gastroenterología del Perú 2004;24 (1):92-96.
- Tagle M, León-Barúa R. Hepatitis A como factor desencadenante de hepatitis autoinmune. Reporte de un caso y revisión de la literatura. Rev Gastroenterol Perú 2003;23:134.
- Gimson AE, White YS, Eddelston AL et al. Clinical and prognostic differences in fulminant hepatitis type A, B and non-A, non-B. Gut 1983;24:1194.
- Vento S, Garofano T, Renzini C et al. Fulminant hepatitis associated with hepatitis A virus superinfection in patients with chronic hepatitis C. N Engl J Med 1998;338:286.
- Hutin YJ, Pool V, Cramer EH et al. A multistate, foodborne outbreak of hepatitis A. N Engl J Med 1999;340:595.
- OEGrady J. Management of acute and fulminant hepatitis A. Vaccine , 1992;suppl. 1:S21.
- Craig AS, Schaffner W. Prevention of hepatitis A with the hepatitis A vaccine. NEJM 2004;350:476-481.
- Stokes J, Neefe JR. The prevention and attenuation of infectious hepatitis by gamma globulin: preliminary note. JAMA 1945;127:144.
- Center for Disease Control. Licensure of inactivated hepatitis A vaccine and recommendations for use among international travelers. MMWR 1995;44:559.
- Fiore AE, Shapiro CN, Sabin K et al. Hepatitis A vaccination on infants: effect of maternal antibody status on antibody persistence and response to a booster dose. Pediatr Infect Dis J 2003;22:354.
- Hepatitis A vaccine. Medical Letter on Drugs & Therapeutics 1995;37:51.
- Neilsen GA, Bodsworth NJ, Watts N. Response to hepatitis A vaccination in human immunodeficiency virus-infected and uninfected homosexual men. J Infect Dis 1997;176:1064.
- Wiens B, Bohidar N, Pigeon J et al. Duration of protection from clinical hepatitis A disease after vaccination with VAQTA« . J Med Virol 1996;49:235.
- Center for Disease Control. Notice to readers: FDA approval for a combined hepatitis A and B vaccine. MMWR 2001;50:806.
- Wong DC, Purcell RH, Sreenivasan MA et al: Epidemic and enteric hepatitis in India: evidence for non-A, non-B etiology. Lancet 1980;2:876.
- Myint H, Soe MM, Khin T et al. A clinical and epidemiological study of an epidemic of non-A, non-B hepatitis in Rangoon. Am J Trop Med Hyg 1985;34:1183.
- Reyes GR, Purdy MA, Kim PJ et al. Isolation of a cDNA from the virus responsible for enterically transmitted non-A, non-B hepatitis. Science 1990;247:1335.
- Bradley DW. Hepatitis E virus: a brief review of the biology, molecular virology, and immunology of a novel virus. J Hepatology 1995;22:140.
- Schlauder GG, Frider B, Sookian S et al. Identification of two novel isolates of hepatitis E virus in Argentina. J Infec Dis 2000;182:294.
- Worm HC, Schlauder GG, Wurzer H, Mushawas IK. Identification of a novel variant of hepatitis E virus in Austria: sequence, phylogenetic and serological analysis. J Gen Virol 2000;81:2885.
- Wald A. Hepatitis E. Adv Ped Inf Dis 1995;10:157.
- Paul DA, Knigge MF, Ritter A et al. Determination of hepatitis E virus seroprevalence by using recombinant fusion proteins and synthetic peptides. J Infect Dis 1994;169:801.
- Clemente-Casares P, Pina S, Buti M et al. Hepatitis E virus epidemiology in industrializad countries. Emerg Infect Dis 2003;9:448.
- Fix AD, Abdel-Hamid M, Purcell RH et al. Prevalence of antibodies to hepatitis E in two rural Egyptian communities. Am J Trop Med Hyg 2000;62:519.
- Ooi WW, Gawoski JM, Yarbough PO, Pankey GA. Hepatitis E seroconversion in United States travelers abroad. Am J Trop Med Hyg 1999;61:822.
- Van der Poel WHM, Verschoor F, Van der Heide R et al. Hepatitis E virus sequences in swine related to sequences in humans, the Netherlands. Emerg Infect Dis 2001;7:970.
- Kabrane-Lazizi Y, Fine JB, Elm J et al. Evidence for widespread infection of wild rats with hepatitis E virus in the United States. Am J Trop Med Hyg 1999;61:331.
- Tien N-T, Claysson HT, Khiem HB et al. Detection of immunoglobulin G to hepatitis E virus among several animal species in Vietnam. Am J Trop Med Hyg 1997;57:211.
- Meng XJ, Wiseman B, Elvinger F et al. Prevalence of antibodies to hepatitis E virus in veterinarians working with swine and in normal blood donors in the United States and other countries. J Clin Microbiol 2002;40:117.
- Vildósola H, Colichón A, Barreda M, Piscoya J, Palacios O. Seroprevalencia de anticuerpos IgG contra el vírus de la hepatitis E en un grupo de riesgo en Lima. Rev Gastroentero- logía del Perú 2002;(20);2.
- Velásquez O, Stetler HC, Avila C et al: Epidemic transmission of enterically transmitted non-A, non-B hepatitis in Mexico, 1986 - 1987. JAMA 1990;263:3281.
- Robson SC, Adams S, Brink N et al. Hospital outbreak of hepatitis E. Lancet 1992;339:1424.
- Belabbes E-H, Bougermouh A, Benatallah A et al. Epidemic non-A, non-B viral hepatitis in Algeria: strong evidence for its spreading by water. J Med Virol 1985;16:257.
- Bradley DW. Hepatitis E virus: a brief review of the biology, molecular virology, and immunology of a novel virus. J Hepatology 1995;22:140.
- Krawczynski K, Bradley DW. Enterically transmitted non-A, non-B hepatitis: identification of virus-associated antigen in experimentally infected cynomolgus monkeys. J Infect Dis 1989;159:1042.
- Jameel S, Durgapal H, Habibullah CM et al. Enteric non-A, non-B hepatitis: epidemics, animal transmission and hepatitis E virus detection by the polymerase chain reaction. J Med Virol 1992;37:263.
- Drabick JJ, Gambel JM, Gouvea VS et al. A cluster of acute hepatitis E infection in United Nations Bangladeshi peace keepers in Haiti. Am J Trop Med Hyg 1997;57:449.
- Purdy MA, McCaustland KA, Krawczynski K et al. Preliminary evidence that a trpE-HEV fusion protein protects cynomolgus macaques against challenge with wild-type hepatitis E virus (HEV). J Med Virol 1993;41:90.
1 Profesor Asociado de Medicina, Universidad Peruana Cayetano Heredia (UPCH). |
