Nódulo tiroideo
Jaime E. Villena Chávez (1)
El bocio nodular ha sido reconocido desde la antigüedad, tratado por la medicina china con extractos de tiroides desecado, posteriormente en el siglo 19 después del descubrimiento del yodo por Courtois y por los trabajos de Chatin es asociado a la deficiencia de yodo y se inicia su prevención con este elemento a partir de los trabajos de Marine y col. (1). A pesar de estas medidas es una condición clínica muy frecuente, porque en su fisiopatología intervienen otros factores adicionales a la carencia de yodo y no hay aún unanimidad de criterio para su manejo adecuado (2,3). En esta revisión nos vamos a ocupar del nódulo tiroideo no funcionante.
Epidemiología e Historia natural
El nódulo tiroideo tiene una prevalencia de 2-6% de acuerdo a la palpación, 19 % a 35% cuando se usa la ecografía tiroidea y entre 8-65% en series de autopsia. Aumenta en frecuencia con la edad y es cuatro veces más prevalente en mujeres que en hombres (4) y en zonas con deficiencia de yodo (5).
El nódulo solitario a la palpación en un 50% está acompañado de otros nódulos cuando se practica la ecografía de tiroides y la incidencia de cáncer es la misma en ambas situaciones (6).
En un seguimiento entre 9 a 11 años se ha observado que el 43% de los nódulos desaparecieron o se redujeron de tamaño, 23% aumentaron de tamaño y un 33% permanecieron sin variación (7, 8).
Etiología y fisiopatología
La etiología del nódulo tiroideo (9) se muestra en la siguiente tabla 1.
En una serie nuestra (10) de nódulos fríos, correspondieron a carcinoma el 29%, 72% del tipo papilar, 22% del tipo folicular y 3% cáncer medular. Las lesiones benignas correspondieron al 71%, de éstas el nódulo adenomatoso representó el 57.4%, 31.2% el adenoma folicular, 1.8% el adenoma papilar y 7.6% de éstas lesiones tenían tiroiditis linfocítica asociada.
La deficiencia de yodo es el factor ambiental más contribuyente para el bocio endémico y esporádico, habiendo una correlación inversa entre el tamaño y la excreción urinaria de yodo. Otro factor es el sexo, puesto que los nódulos son 5 a 10 veces más frecuentes en mujeres que en hombres. Factores adicionales son el tabaquismo, la ingesta de bociógenos (vg. crucíferas), inflamación y la presencia de depresión asociado a trastorno de pánico y agorafobia (11). La ingesta de alcohol está asociada a un menor volumen tiroideo y menor prevalencia de nódulos. Factores genéticos también están implicados. Hay una concordancia de 80% de bocio en mujeres gemelas monocigóticas en zonas con deficiencia de yodo y 42% en zonas no deficientes de este elemento. La herencia de bocio entre mujeres en zonas no deficientes de yodo ha sido calculada en 82%. (IC 95 % 67%-92). Se ha identificado en el cromosoma 14 un locus (MNG-1) en población francesa residentes en Canadá que esta asociado a bocio multinodular (11).
La historia de radiación por más de 50 rads (50 cGrays), de 100-700 cGrays durante la niñez en los primeros 3 ó 4 años de vida, ha sido asociada a la presencia de bocio nodular y cáncer de tiroides 10 a 30 años después. En pacientes que reciben radioterapia en la región cervical el riesgo de cáncer de tiroides es 15 a 53 veces mayor (12,13). Después del accidente de Chernobyl se han reportado 5000 casos de cáncer de tiroides particularmente en menores de 5 años (14).
Se ha demostrado la asociación de los oncogenes tiroideos y el cáncer. Es el caso de los oncogenes RET/PTC, RAS: Hras, KrasA, KrasB, NrasY y BRAF para el cáncer papilar. Las traslocaciones PAX8–PPARγ y mutaciones en RAS en el cáncer folicular y mutaciones en BRAF y p53 en el cáncer anaplásico (15).
Un punto controversial es el de la posibilidad que un nódulo benigno se transforme en maligno con el tiempo. Una reciente revisión indica que en la experiencia a 10 años de los autores, 2% de los cánceres de tiroides emergieron de una lesión pre existente benigna. Marcadores celulares y tumorales como Gal-3, CITED1, HBME-1, Ras, RET/PTC y PAX8/PPARγ, han sido identificados en tumores benignos sugiriendo que los adenomas folicular y a células de Hurthle tienen similitudes con los carcinomas y que algunos de éstos serian lesiones pre malignas. Adicionalmente 10% de tumores foliculares extirpados, en la serie de estos autores son tumores bien encapsulados con atipia nuclear, lo que ha llevado a denominarlos tumores bien diferenciados de potencial maligno incierto, los cuales pudieran ser precursores de los carcinomas (16).
Diagnóstico
1. Evaluación Clínica
El nódulo tiroideo reviste importancia por las consecuencias clínicas que puede acarrear (11,17-19). Por su tamaño puede comprimir la tráquea produciendo traqueomalacia, infiltrar el nervio laríngeo recurrente o comprimir el esófago ocasionando tos, disnea, disfonía, estridor o disfagia respectivamente. En el caso de nódulos autónomos éstos pueden ocasionar hipertiroidismo cuando adquieren cierto tamaño y finalmente los nódulos pueden albergar un cáncer de tiroides. La evaluación clínica debe estar encaminada a detectar signos y síntomas sugestivos de malignidad tiroidea.
Se debe indagar en los pacientes por antecedente de enfermedades tiroideas familiares, cáncer medular, cáncer papilar, neoplasia endocrina múltiple (MEN 2), poliposis coli, enfermedad de Cowden y Gradner, que están asociados a una mayor frecuencia de cáncer. Igualmente sobre antecedente de irradiación cervical previa y residencia en zonas con deficiencia de yodo, donde no solo la frecuencia de nódulos no funcionantes es mayor sino también la de nódulos autónomos antes y después de la erradicación de la carencia de yodo (20). Asimismo se debe interrogar sobre síntomas de disfunción tiroidea.
La mayoría de veces el nódulo no produce síntomas. En algunos casos un nódulo inadvertido puede ponerse de manifiesto al producirse hemorragia intranodular, causando dolor tiroideo intenso que cede a la evacuación (9). Un nódulo de crecimiento rápido sugiere linfoma o cáncer anaplásico. Un nódulo de crecimiento lento pero progresivo también es sugestivo de malignidad (21).
Aunque generalmente los bocios multinodulares son los que más ocasionan compresión de estructuras vecinas, la presencia de disfonía y tos en ausencia de estos es indicador de malignidad. Un nódulo preponderante dentro de un bocio multinodular también conlleva un mayor riesgo de cáncer
Los signos y síntomas que conllevan un mayor riesgo de malignidad en el caso de los nódulos tiroideos, son los siguientes (11,17-19,21):
• Irradiación cervical previa.
• Historia familiar de cáncer medular de tiroides, MEN .
• Edad menor de 20 años o mayor de 70 años.
• Sexo masculino.
• Nódulo creciente.
• Nódulo de consistencia firme y bordes no definidos a la palpación.
• Nódulo fijo a planos profundos.
• Presencia de disfonia, disfagia, tos.
• Adenopatía cervical satélite.
2. Evaluación hormonal
Se recomienda la determinación de TSH mediante técnicas de tercera generación que detectan niveles de 0.01 uUI/ml. Si la TSH es normal no se requiere mayor investiga-ción. Si esta fuera mayor que el límite superior normal debe solicitarse T4 libre y determinación de Ab antiperoxidasa (Anti TPO) para evaluar la posibilidad de hipotiroidismo y/o tiroiditis de Hashimoto. Si la TSH es menor que el límite inferior normal se solicitará T4 libre y T3 para descarte de tirotoxicosis por nódulo autónomo, junto con una gammagrafía tiroidea o más raramente hipotiroidismo central (11, 17-19, 21).
La determinación de calcitonina ha permitido detectar la presencia de cáncer medular de tiroides en el 0.57 % de nódulos (22), sin embargo actualmente su determinación rutinaria no se recomienda, salvo en los casos de antecedente de cáncer medular familiar o MEN 2 (11,17-19, 21, 23). El valor normal es < 10 pg/ml. Valores entre 10-100 pg/ml requieren mayor evaluación, niveles > 100 pg/ml son muy sugestivo de cáncer medular de tiroides.
La tiroglobulina sérica correlaciona con el tamaño del bocio y con el balance de yodo de la persona. No distingue entre nódulos benignos de malignos, por lo que su determinación rutinaria tampoco se recomienda (11, 21).
3. Biopsia por aspiración con aguja fina
Es el método de elección para determinar la presencia de cáncer en un nódulo (11, 17-19, 21, 24). Introducida en la década de los sesenta su uso ha sido rutinario a partir de los años ochenta del siglo pasado.
Se realiza sin anestesia de preferencia en un nódulo palpable y con una aguja de calibre entre 23 a 27 y de 3.5 cm de longitud. Se introduce la aguja en el nódulo y se ejerce una succión suave mientras se dirige la aguja en diferentes planos del nódulo, La succión se detiene cuando uno va a retirar la aguja. La muestra se extiende en láminas portaobjetos y se introduce en una solución de alcohol al 95% o en alcohol medicinal rutinario.
Un espécimen es adecuado para su examen si contiene por lo menos 6 grupos de células epiteliales bien conservadas con 10 células en cada uno de ellos., de lo contrario la muestra es considerada como no adecuada. Esto depende de la experiencia del que hace la biopsia.
El uso de este método diagnóstico ha reducido las tiroidectomías innecesarias en un 50%, aumentado en un 200% los diagnósticos de cáncer postoperatorios y ha reducido en un 25 % los costos del cuidado de la salud en estos pacientes (21).
La biopsia es informada de la siguiente manera (11, 21, 24) con los porcentajes derivados de diferentes series:
• Diagnóstica 80%
• Benigno: 69 % (53 % - 90 %)
• Maligno: 4 % (1 % - 10 %)
• Sospechoso 10 % (5 % - 23 %)
• No diagnóstica 17 % (15 % -20 %)
Cuando la muestra es no diagnóstica puede repetirse. La biopsia con aguja fina no puede distinguir entre adenomas foliculares y cáncer folicular. La frecuencia de malignidad en especímenes sospechosos es de 20 a 30 %.
La precisión de la biopsia por aguja fina (21) es la siguiente:
Ecografía
La ecografía tiroidea es el método de elección para evaluar la morfología de la glándula tiroides (11,17-19,21,25). Con traductores de alta frecuencia (7-13 MHz) es posible detectar nódulos de 2 mm a 3 mm particularmente si son quísticos y con el doppler a color permite valorar el flujo vascular intranodular.
Las ventajas de este método son:
• Amplia disponibilidad.
• Evita la radiación.
• Poca molestia para el paciente y puede realizarse al pie de la cama.
• Gran resolución para detectar nódulos.
• Permite valorar el volumen de la tiroides.
• Permite visualizar flujo vascular.
• Permite realizar biopsia por punción dirigida.
Las desventajas son:
• Depende de la experiencia del operador.
• No informa sobre la funcionalidad del tejido.
• No es útil para detectar bocios sumergidos.
• Pobre valor predictivo de malignidad.
Las características ecográficas que sugieren malignidad de un nódulo (25) son las siguientes:
• Microcalcificaciones.
• Márgenes irregulares o signo de halo ausente.
• Aspecto sólido.
• Vascularización intranodular.
• Forma (diámetro vertical > que el horizontal, más alto que ancho).
Aisladamente estos signos tienen poca especificidad y sensibilidad.
Recientemente la introducción de la elastografia, que mide la elasticidad del tejido tumoral permite valorar la malignidad del nódulo con una especificidad del 96% y sensibilidad del 82 % (25).
4. Gammagrafía
Permite valorar la función del nódulo, en aquellos casos en que la TSH esté suprimida.
Detecta nódulos mayores de 10 mm, el SPECT mejora la resolución de 6 a 7 mm muy inferior a la de la ecografía. Actualmente se usa más el 99mTc, por su vida media corta (6 horas) menor emisión de radiaciones que el 131I y el examen se puede hacer el mismo día. Los inconvenientes es que no es organificado por la tiroides, puede tener un 3 a 8 % de falsos positivos y es de uso parenteral. Se ha recomendado el uso de 123I por su menor emisión de radiaciones que el 131I, lamentablemente no está disponible en el país (9,11,17-19,21).
Entre el 77 % - 94 % de los nódulos son fríos y de estos entre el 8% - 25 % son malignos (11). En nuestra institución (26) de 420 casos de nódulos tiroideos 65.3% fueron fríos, 29.8% calientes y 5% tibios. En los procedentes de zonas yodo deficientes el 35.5 % tuvieron nódulos calientes, RR=1.92, IC: 1.33-2.77. El 29% de los nódulos fríos fueron malignos.
La gammagrafia tiroidea es útil en los casos de bocio retroesternal y para detectar tejido remanente post tiroidectomía o tejido ectópico (11, 21).
5. Tomografía axial computarizada (TAC) y resonancia magnética nuclear (RMN)
La TAC y la RMN (11, 21) no pueden diferenciar entre un nódulo maligno de uno benigno. No se utilizan en la evaluación inicial del bocio nodular. Su utilidad radica en la evaluación del bocio retroesternal, la evaluación de la compresión traqueal, la detección de recurrencia de un carcinoma y de adenopatías cervicales y mediastinales en casos de cáncer de tiroides.
La evaluación del metabolismo de la glucosa por parte de un nódulo se puede determinar por medio de la tomografía por emisión de positrones (PET scan) usando fluorodeoxiglucosa (FDG), lo cual permite distinguir entre un nódulo benigno y uno maligno que tiene un metabolismo mayor. También es útil para detectar metástasis ocultas y predecir el comportamiento del tumor en base al volumen valorado por FDG (27).
Tratamiento
Se han desarrollado diferentes algoritmos para el manejo de los nódulos tiroideos (21,28,29), presentamos en la figura 1, el desarrollado por la Asociación Americana de Endocrinólogos Clínicos /AACE) en 2006 (21), el cual se basa en la evaluación inicial con ecografía y TSH, seguida de acuerdo a los resultados por la biopsia por aspiración con aguja fina. Los casos con resultado maligno o sospechoso son derivados para cirugía de tiroides Los nódulos benignos quísticos son tratados con inyección percutánea de etanol y los sólidos son tributarios de tratamiento con levotiroxina. Los nódulos calientes son observados si no están descompensados o son tratados con 131I en caso contrario.
Tradicionalmente se ha dado tratamiento con levotiroxina para disminuir el nivel de TSH y lograr así reducir el tamaño de los nódulos tiroideos, lo cual solo se logra en un 20 % de pacientes en forma significativa, sobre todo en aquellos con nódulos pequeños, de reciente diagnóstico, con características de coloide y en zonas con deficiencia de yodo (11,21,30-42). También se puede evitar el crecimiento de nuevos nódulos. Hay que tener en cuenta los efectos adversos de esta terapia, la tirotoxicosis subclínica con riesgo de 2 a 3 veces mayor de fibrilación auricular y la osteoporosis (43,44).
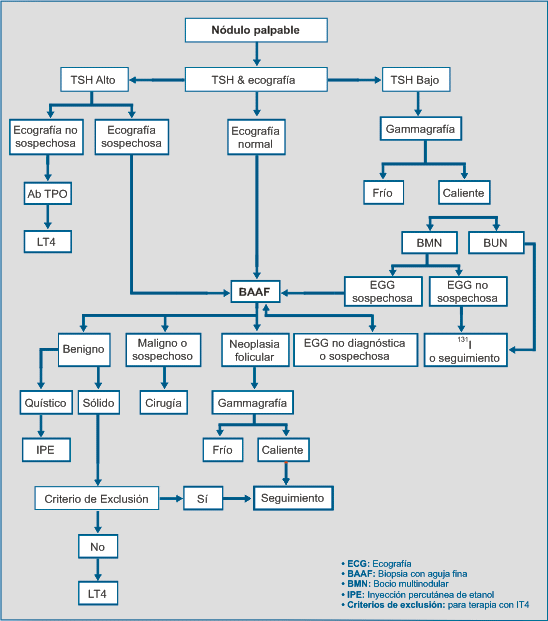 |
| Figura 1. Algoritmo para el Manejo del Nódulo Tiroideo (Adaptado de AACE 2006). |
El nódulo tiroideo no palpable (incidentaloma)
Es una condición frecuente ahora que se usa rutinariamente la ecografía y para cuyo manejo tampoco hay consenso. El consenso europeo (29) sugiere la biopsia solo si la ecografía mostrara signos sospechosos de malignidad. Una reciente publicación (45) muestra que la frecuencia de cáncer en estos nódulos pueden ser igual y mayor que en los nódulos de mayor tamaño y sugiere la biopsia si la ecografía es sospechosa. Mazzaferri y col. (46) muestran que la biopsia por aspiración tiene una alta tasa de falsos positivos en nódulos menores de 5mm y que no deben ser biopsiados pese a hallazgos ecográficos sospechosos. La AACE (21) ha propuesto para el manejo de esta condición el algoritmo que se presenta en la figura 2.
 |
| Figura 2. Algoritmo para el Manejo del Nódulo Tiroideo no Palpable (Adaptado de AACE 2006). |
Bibliografía
- Lason AH. The Thyroid Gland in Medical History. New York, Fraber Press 1946.
- Gharib H, Papini E, Paschke R. Thyroid nodules: a review of current guidelines, practices, and prospects. European Journal of Endocrinology 2008;159:493-505.
- Castro MR, Gharib H. Continuing Controversies in the Management of Thyroid Nodules. Ann Intern Med. 2005;142:926-931.
- Dean SD, Gharib H. Epidemiology of thyroid nodules. Best Practice & Research Clinical Endocrinology & Metabolism 2008;22:901-911.
- Medeiros-Neto G. Iodine deficiency disorders. In: de Groot LJ, Jameson JL, eds. Endocrinology. Philadelphia:WBSaunders; 2000;1529-1539.
- Tan GH, Gharib H, Reading CC. Solitary thyroid nodule; comparison between palpation and ultrasonography. Arch Intern Med 1995;115:2418.
- Kuma K, Matsuzuka F, Kobayashi A, et al. Outcome of long standing solitary thyroid nodules. World J Surg 1992;16:583-587; discussion 587-588.
- Kuma K, Matsuzuka F, Yokozawa T, et al. Fate of untreated benign thyroid nodules: Results of long-term follow-up. World J Surg 1994;18:495- 498.
- Kaplan M. Clinical evaluation and management of solitary thyroid nodules. En: Braverman LE, Uttinger RD (eds). Werner and Ingbar´s: The Thyroid. A Funda-mental an Clinical Text. Philadelphia: Lippincott Williams & Wilkins; 2005;996-1010.
- Villena J. Nódulo Tiroideo frío en pacientes de la costa y de zonas yodo deficientes. Revista Medica Herediana; 1993;4:188-193.
- Laszlo Hegedus, Steen J. Bonnema, Finn N. Bennedbæk. Management of Simple Nodular Goiter: Current Status and Future Perspectivas. Endocrine Reviews 2003;24:102-132.
- Jereczek-Fossa BA, Alterio D, Jassem J, Gibelli B, Tradati N, Orecchia R. Radiotherapy-induced thyroid disorders. Cancer Treat Rev. 2004;30:369-384.
- Sarne D, Schneider AB. External radiation and thyroid neoplasia.Endocrinol Metab Clin North Am. 1996; 25:181-195.
- Reiners C, Demidchik YE, Drozd VM, Biko J. Thyroid cancer in infants and adolescents after Chernobyl. Minerva Endocrinol. 2008;33:381-395.
- James A. Fagin. Molecular pathology of thyroid cancer: diagnostic and clinical implications. Best Practice & Research Clinical Endocrinology & Metabolism 2008;22:955-969.
- Arora N, Scognamiglio T, Zhu B, Fahey TJ. 3rd. Do benign thyroid nodules have malignant potential? An evidence-based review. World J Surg. 2008l;32:1237-1246.
- Laszlo Hegedüs. The Thyroid Nodule. N Eng J Med 2004;351:1764-1771.
- Yeung MJ, Serpell JW. Management of the Solitary Thyroid Nodule. The Oncologist 2008;13:105-112.
- Jeffrey R. Garber Thyroid Nodules 2006: Managing what has been known for over 50 years. Hormones 2006;5:179-186.
- Pretell EA, Higa AM. Eliminación sostenida de los desórdenes por deficiencia de yodo en Perú 25 años de experiencia. Acta Med Per 2008;25:128-134.
- American Association of Clinical Endocrinologists and Associazione Medici. Endocrinologi Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules. Endocrine Practice 2006;12: 63-102.
- Pacini F, Fontanelli M, Fugazzola L, Elisei R, Romei C, Di Coscio G, et al. Routine measurement of serum calcitonin in nodular thyroid diseases allows the preoperative diagnosis of unsuspected sporadic medullary thyroid carcinoma. J Clin Endocrinol Metab. 1994;78:826-829.
- Elisei R. Routine serum calcitonin measurement in the evaluation of thyroid nodules. Best Practice & Research Clinical Endocrinology & Metabolism, 2008;22:941-953.
- Baloch ZW, LiVolsi VA. Fine-needle aspiration of the thyroid: today and tomorrow. Best Practice & Research Clinical Endocrinology & Metabolism, 2008;22: 929-939.
- Rago T, Vitti P. Role of thyroid ultrasound in the diagnostic evaluation of thyroid nodules. Best Practice & Research Clinical Endocrinology & Metabolism, 2008;22:913-928.
- Villena J. Aspectos Clínicos del Bocio Nodular. Experiencia de 15 años. Boletín de la Sociedad Peruana de Medicina Interna, 1992;5:71-76.
- Robbins RJ, Larson SM. The value of positron emission tomography (PET) in the management of patients with thyroid cancer. Best Practice & Research Clinical Endocrinology & Metabolism, 2008;22:1047-1059.
- Cooper DS, Doherty GM, Haugen BR, Kloos RT, Lee SL, Mandel SJ, Mazzaferri EL, McIver B, Sherman SI, Tuttle RM. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2006;16:109-142.
- Pacini F, Schlumberger M, Dralle H, Elisei R, Smit JW, Wiersinga W and the European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. European Journal of Endocrinology 2006;154:787-803.
- Gharib H, Mazzaferri EL. Thyroxine suppressive therapyin patients with nodular thyroid disease. Ann Intern Med. 1998;128:386-394.
- Papini E, Bacci V, Panunzi C, et al. A prospective randomized trial of levothyroxine suppressive therapy for solitary thyroid nodules. Clin Endocrinol (Oxf). 1993;38:507-513.
- Wemeau JL, Caron P, Schvartz C, et al. Effects of thyroid-stimulating hormone suppression with levothyroxine in reducing the volume of solitary thyroid nodules and improving extranodular nonpalpable changes: a randomized, double-blind, placebo-controlled trial by the French Thyroid Research Group. J Clin Endocrinol Metab. 2002;87:4928-4934.
- Castro MR, Caraballo PJ, Morris JC. Effectiveness of thyroid hormone suppressive therapy in benign solitary thyroid nodules: a meta-analysis. J Clin Endocrinol Metab. 2002;87:4154-4159.
- Zelmanovitz F, Genro S, Gross JL. Suppressive therapy with levothyroxine for solitary thyroid nodules: a doubleblind controlled clinical study and cumulative meta-analyses. J Clin Endocrinol Metab. 1998;83:3881-3885.
- Gharib H, James EM, Charboneau JW, Naessens JM, Offord KP, Gorman CA. Suppressive therapy with levothyroxine for solitary thyroid nodules: a double-blind controlled clinical study. N Engl J Med. 1987;317:70 -75.
- Cheung PS, Lee JM, Boey JH. Thyroxine suppressive therapy of benign solitary thyroid nodules: a prospective randomized study. World J Surg. 1989;13:818-821.
- La Rosa GL, Ippolito AM, Lupo L, et al. Cold thyroid nodule reduction with L-thyroxine can be predicted by initial nodule volume and cytological characteristics. J Clin Endocrinol Metab. 1996;81:4385-4387.
- Csako G, Byrd D, Wesley RA, et al. Assessing the effects of thyroid suppression on benign solitary thyroid nodules: a model for using quantitative research synthesis. Medicine (Baltimore). 2000;79:9-26.
- Papini E, Petrucci L, Guglielmi R, et al. Long-term changes in nodular goiter: a 5-year prospective randomized trial of levothyroxine suppressive therapy for benign cold thyroid nodules. J Clin Endocrinol Metab. 1998;83:780-783.
- Sdano MT, Falciglia M, Welge JA, Steward DL. Efficacy of thyroid hormone suppression for benign thyroid nodules: meta-analysis of randomized trials. Otolaryngol Head Neck Surg. 2005;133:391-396.
- Richter B, Neises G, Clar C. Pharmacotherapy for thyroid nodules. A systematic review and meta-analysis.Endocrinol Metab Clin North Am. 2002;31:699-722.
- Castro MR, Caraballo PJ, Morris JC. Effectiveness of thyroid hormone suppressive therapy in benign solitary thyroid nodules: a meta-analysis. J Clin Endocrinol Metab. 2002;87:4154-4159.
- Faber J, Galloe AM. Changes in bone mass during prolongad subclinical hyperthyroidism due to L-thyroxine treatment: a meta-analysis. Eur J Endocrinol. 1994;130:350-356.
- Uzzan B, Campos J, Cucherat M, Nony P, Boissel JP, Perret GY. Effects on bone mass of long term treatment with thyroid hormones: a meta-analysis. J Clin Endocrinol Metab. 1996;81:4278-4289.
- Berker D, Aydin Y, Ustun I, Gul K, Tutuncu Y, Isik S, Delibasi T, Guler S. The value of fine-needle aspiration biopsy in subcentimeter thyroid nodules.: Thyroid. 2008;18:603-608.
- Mazzaferri EL, Sipos J. Should all patients with subcentimeter thyroid nodules undergo fine-needle aspiration biopsy and preoperative neck ultrasonography to define the extent of tumor invasion?. Thyroid. 2008;18:597-602.
1 Profesor Principal de la Facultad de Medicina Alberto Hurtado, Universidad Peruana Cayetano Heredia (UPCH). |
