El futuro de la Patología
Javier Arias-Stella (1)
Con la incorporación de la inmunohistoquímica que ha dado una nueva dimensión a la histomorfología enlazándola, en alguna forma, a la química celular; la cito e histomorfología analítica o cito-histométría -que ha traído una dimensión cuantificable y por ende más científica a la morfología clásica(1,2,3); la telepatología, en sus distintas formas, de la mano con los sistemas de la computación y sus desarrollos sofisticados, que le han dado un cambio radical a las posibilidades de la interconsulta, estudios paralelos, investigaciones masivas, investigación simultánea en tiempo real, en zonas distantes; la aplicación de noveles tecnologías para el reconocimiento, visualización, medición de los efectos en los tejidos blanco, y mesura de los intermediarios químicos en el complejo campo de la interrelación entre las células; la citogenética y la develación del código del ADN que han abierto, cual el descubrimiento del significado de los jeroglifos egipcios, el camino para descubrir el lenguaje de las células; la Patología, y en general, la Medicina, ha iniciado un camino -como nunca antes en la historia de la evolución médica- que parece, por la velocidad de los cambios que se vienen suscitando, conducirán a una nueva forma de acción y enfoque de lo que hasta ahora hemos concebido como la especialidad de Patología y lo que hasta ahora concebimos como el ejercicio correcto de la Medicina.
La doctora Mary E. Kass, Presidenta de la Fundación del Colegio Americano de Patólogos, se ha preguntado recientemente (4) "¿Estaremos todavía viendo al microscopio para hacer un diagnóstico de aquí a 20 años? ¿O la práctica de la patología va a cambiar tan significativamente que no vamos a usar el microscopio rutinariamente?". Ella continúa su reflexión de la siguiente manera: "Tengo la impresión que no estaremos usando láminas de vidrio. No estaremos cortando bloques de parafina y no estaremos mirando al microscopio. Hay mucha gente y varias compañías que están, en estos momentos, haciendo fenomenales esfuerzos y excitantes investigaciones para encontrar nuevas formas de diagnóstico". El asunto es, concluye, si es que nos incorporamos o no a esta nueva corriente.
El doctor Schwartz (5), actual presidente del Colegio Americano de Patología, se pasó los últimos dos años visitando y conversando con residentes y directores de laboratorios de patología preguntando y discutiendo sobre el futuro de la patología. Su pregunta era ¿que estaremos haciendo como patólogos no en 20 años, pero en 5 o quizás 3 años? Algunos contestaron: no se puede predecir el futuro. Un gran grupo está trabajando en problemas concretos que, sin duda, darán respuestas a interrogantes puntuales y serán útiles. Mi impresión, dice Schwartz es que "no estaremos haciendo lo que hacíamos en el pasado o practicando la patología como la practicamos ahora". "Tenemos nuevas armas y el enfoque de nuestra práctica será diferente". En mis viajes, añade Schwartz, he notado que este tema es también el tema de otras especialidades. Y todas hablan de los cambios dramáticos que enrrumban a una transformación en el ejercicio médico. El asunto para los patólogos -y por extensión para otras especialidades- es cómo nos acomodamos a una nueva realidad.
En la Conferencia convocada por el colegio Americano de Patólogos "Future Escape of Pathology" en junio del 2007, le tocó al doctor Friedman de la Universidad de Michigan Medical School, discutir las fuerzas que hoy están cambiando la anatomía patológica (6). Friedman considera que la anatomía patológica consiste de: patología quirúrgica, citopatología y patología de autopsia. A la última la describe como "dying art". Una definición sin duda personal, esquemática y restringida, con la que no estoy de acuerdo. Friedman considera que aunque la histopatología y la citopatología son disciplinas subjetivas (en lo que está acertado), constituyen las modalidades o pruebas de oro ("gold standard") para el diagnóstico tisular. Ahora son las reinas supremas y continuarán siéndolo, por un tiempo en el futuro, a pesar de su carácter subjetivo. Obviamente su posición es menos tremendista que la de la doctora Kass. Lo primero que debemos reconocer es que actualmente están emergiendo técnicas de imagenología molecular, todavía en su primera fase, pero que constituyen potencialmente, técnicas competidoras para la histopatología en el diagnóstico tisular. Sin embargo, los radiólogos y las compañías que están impulsando investigaciones en imagenología molecular necesitarán siempre del patólogo quirúrgico para validar sus diagnósticos.
Las 10 fuerzas de cambio
Al tratar de identificar las 10 fuerzas que están cambiando la anatomía patológica, se hizo evidente que ellas están más allá del control posible para los que practican la anatomía patológica. En otras palabras, hay grandes fuerzas macroeconómicas interesadas. Pero tenemos acciones por tomar para contrarrestar esta tendencia. Uno de los primeros caminos en este fin es la integración de la patología clínica con la anatomía patológica. Esto debería ocurrir en todos los departamentos de patología.
Entrando al tema
La Primera Fuerza:
- Ésta es la denominada "The early health model". Puesta en pocas palabras su definición es: "El diagnóstico en la etapa presintomática, preclínica, el diagnóstico de precancer". Es decir, nos motiva hoy la posibilidad de inventar o desarrollar pruebas, técnicas y equipos, que nos permitan reconocer la enfermedad (o la etapa previa, o potencial para desarrollarla) antes que esta se haya manifestado. Esto es averiguación en el hombre sano de su potencial de desarrollar un mal.
- Con este objetivo compañías y empresarios, viendo las ganancias futuras de sus inversiones -tales como General Electric (Fairfield, Conn.) y Siemens Medical Solutions USA (Malvern, Pa.)- están embarcados en el desarrollo de noveles equipos y pruebas.
- Es obvio que este concepto de "early health model" va a introducir nuevas variables en la relación médico-paciente y, en general, en todos los estamentos que tienen que ver con la salud: Compañías de Seguros, Clínicas, compañías farmacéuticas, educación médica, etc.
- Se va a comenzar a diagnosticar la enfermedad pre-clínica y presintomática. Hoy los clínicos no están preparados ni entrenados para esto. Las compañías de Seguros tampoco; los Seguros de salud solo reconocen beneficios para el enfermo con diagnóstico probado. Las compañías farmacéuticas descansan en los derechos de propiedad intelectual de drogas que han demostrado efectividad en enfermedades comprobadas.
- Los patólogos y laboratoristas deben estar en el epi-centro de esta revolución que está ya comenzando con el uso de los biomarcadores
- El doctor Friedman considera -mirando al futuro- que los biomarcadores usando solo suero, como fuente de la muestra, serán mucho más baratos en la relación costo-beneficio, que lo que se logra a través de los sofisticados, complejos y costosos modernos estudios de imágenes.
- El camino sería: primero panel de biomarcadores (4) en términos generales de costos bajos o accesibles, luego que este nos ha orientado hacia dónde dirigirnos, seguir con los estudios de imágenes, pero ya enfocados solo al área sugerida o indicada por el biomarcador.
La Segunda Fuerza:
-Así como la medicina molecular (identificación de las moléculas indicadoras de la enfermedad) o "health early medicine" -salud por medicina temprana- está siendo auspiciada y popularizada por General Electric, la medicina molecular y el llamado "servicio de diagnóstico total" está siendo impulsado por Siemens. Esta forma de medicina molecular implica el análisis de las bases moleculares de la enfermedad y su manipulación para mejorar la precisión diagnóstica, la prevención y el tratamiento de la enfermedad (5).
- La medicina molecular nos permite monitorear el tratamiento usando los biomarcadores y la imagenología-molecular (6). Y así llegamos a la discusión sobre la medicina personalizada (dosis, dirección y momento para cada caso individual).
- Es fácil comprender que las dos fuerzas hasta ahora discutidas habrán de expandir su potencial en los programas de "detección y tamizaje" como ahora los concebimos, así como influenciarán en la valoración de la predisposición genética. La pregunta para nosotros los patólogos es cómo nos convertimos de especialistas, esencialmente, morfólogos (a nivel de células y tejidos), en especialistas de la nueva patología molecular.
La Tercera Fuerza:
- Es la búsqueda de indicadores claves (químicos, moleculares o físicos) del pronóstico y de la eficacia de la terapéutica instalada. El diagnóstico va a ser pronto algo a lo que vamos a llegar con precisión con los biomarcadores y la imagenología. Con rapidez los clínicos se orientan ahora, cada vez más, a buscar cómo reconocer y medir el efecto de la terapia. Aquí el énfasis está en combinar las pruebas y técnicas de los "biomarcadores" con las nuevas y sofisticadas técnicas de la "imagenología".
- Lo que se buscará son datos sobre el pronóstico y recomendaciones terapéuticas. No se trata, como en el pasado, decir: este paciente con cáncer de Colon es Duke III y por ende su porcentaje de cinco años de sobrevida es x%, según las estadísticas, si es un Duke II es de y% o si es Duke I de z%. Lo que se buscará es que digamos: la terapia suministrada no ha sido efectiva, porqué las metástasis detectadas no se han achicado; o si hay efecto, el tumor ha disminuido en un 30%; y luego hay que seguir el tratamiento, y en el nuevo control le digamos sigue achicándose ahora es 75% más pequeño y así en el siguiente control le podemos decir la metástasis ha desaparecido (!Eureka¡) -Medicina personalizada-. Este es el escenario donde el patólogo quirúrgico y el laboratorista clínico, de la mano, deberán jugar su papel (su especialidad) en el futuro.
- Si somos capaces de entrar en esta nueva área de juego, seguiremos en carrera, sino nos estancaremos en la primera base, dar el dato morfológico inicial (citológico o histológico) y punto, salimos del interés de los clínicos y de los pacientes.
- Con la medicina personalizada y la terapéutica dirigida ("targeted") seremos capaces de decirle al clínico: no hay efecto definido, el tumor está ahí, como en el último control, recomiendo intentar otra terapia. Nuestros reportes serían dinámicos: "hay o no disminución de volumen y en qué proporción". La terapia sigue o se cambia. Estamos si o no en el camino correcto.
La Cuarta Fuerza:
- Es más que un factor motivante de cambio, un problema socio-económico que debemos enfrentar. Los altos costos de la medicina sofisticada tendrán que ser, en parte, atendidos por los propios pacientes. Tenemos que comprender que los paneles de biomarcadores y los algoritmos -marcadores e imagenología- para lograr el diagnóstico preciso y monitoreo del efecto terapéutico, demandan un costo que no es hoy todavía considerado por las compañías aseguradoras. Friedmann, cree que por ahora estos costos tendrán que salir del bolsillo de los pacientes, pero esto es algo que no se ha enfrentado con criterio de derechos humanos, seguridad social y retribución justa del servicio (médicos y compañías farmacéuticas). Es un problema potencial.
- Obviamente en nuestro caso (Perú) estamos en una fase muy lejana para discutir el tema, pero bien haríamos en ir planteando alternativas, a nivel académico, pues el problema llegará. Esto se da de la mano con la Reforma en la Atención Médica en el Perú, de la que venimos hablando hace más de medio siglo, dando vueltas y revueltas sin llegar a puerto. Por tres razones: falta de conocimiento de la esencia del problema, intereses grupales sindicales, y falta de decisión política.
La Quinta Fuerza:
-Se refiere a la imperativa tendencia a la fusión de la patología, el laboratorio clínico y la radiología. Se sostiene en razones económicas, estrategias políticas de calidad de servicio y consideraciones organizacionales.
- Debemos tomar conciencia que la imagenología está en camino de colisionar con la patología quirúrgica, en el sentido que, cada vez, es más capaz de llegar a un diagnóstico concreto. A eso va la imagenología molecular. Una Universidad con un grant de la General Electric está equipando a todos los estudiantes de medicina con un equipo de ultrasonido portable. Este equipo sustituye el estetoscopio y permite el diagnóstico rápido, en la cama del paciente, en muchas condiciones.
La Sexta Fuerza:
-Es el cambio en la modalidad que se ha venido designando como el chequeo médico periódico. En lugar de los chequeos clásicos de hoy: examen clínico, radiología, exámenes de sangre, citología de "screening", etc. "Un conjunto de biomarcadores" nos darán una orientación inmediata que indicarán la necesidad o no de un monitoreo posterior y serán más precisos y de menor costo y molestia. El dato además nos dará un mayor horizonte de 3 a 5 años, y no el recomendado chequeo anual. No dejarán de haber problemas de "falsos positivos" y problemas éticos, pero aún así, Friedman, piensa que la intervención temprana será más conveniente en la relación costo / efectividad.
Las Séptima, Octava y Novena Fuerzas:
- Están relacionadas con el uso de la nueva tecnolo- gía informática: La Patología Digital. Bases de datos obtenidos por imagenología digital permitirán: comparar la información almacenada, con el caso problema concreto individual; comparar en tiempo real, imágenes con otros laboratorios; buscar opiniones de especialista lejanos. Las imágenes con microscopía ordinaria ("brightfield microscopy") serán reemplazadas con la "hyperspectral imagen" que nos da además, información molecular. Se estima que la medicina de imágenes será la base para el 80% de los diagnósticos y las consultas médicas serán posibles sobre una base global mundial.
- Actualmente la compañía NightHawk Radiology (Coeur D'Alene, Idaho) trabaja solo en radiología digital y es capaz de movilizar sus imágenes alrededor del mundo. Se inició desarrollando un "software" para demostrar la capacidad de globalizar el sistema y ha evolucionado en un modelo para grupos radiológicos que están co-localizados y que intercambian información, consultas, reportes y personal en múltiples y distintas localidades.
- La búsqueda directa de imágenes radiológicas y de imágenes histológicas producidas por bancos de base de datos será una realidad. En el campo microscópico un problema encontrado en una lámina en estudio podrá ser comparado con campos similares provenientes de la base de datos, de manera rutinaria. Claro esto será posible cuando la patología se convierta en totalmente digital. Tendremos acceso a casos similares previos, en tiempo real, para hacer un diagnóstico diferencial. La base de datos nos ofrecerá también las imágenes de casos de baja incidencia. Las enfermedades o casos raros también podrán ser comparados. Tendremos conocimiento rápido de un "cohort" de casos raros que existen y que podremos comparar con nuestro caso problema individual.
La Décima Fuerza:
- Es también más que motivación de cambio, problema que tenemos que resolver: Cómo desarrollar una estrategia para contrarrestar la actual comercialización de la medicina de laboratorio. Este dilema proviene de la competencia que se ha establecido entre los llamados Laboratorios nacionales de referencia: Quest (Lyndhurst, N.J.) y LabCorp (Burlington, NC) que se disputan actualmente los controles con las compañías aseguradoras, sobre la base de costos. Para Friedman el antídoto será desarrollar pruebas genómicas y proteómicas asociadas a algoritmos sofisticados que permitan la interpretación de las pruebas que sueltan esos laboratorios de referencia o también podemos desarrollar consultas sofisticadas de correlación con la imagenología médica. El asunto es estar "ahead".
El análisis multiespectral de imágenes en patología
En la Conferencia del Colegio Americano de Patólogos. "Futurescape of pathology, en Rosemont, III., Junio 2007; el doctor Richard Levenson del Cambridge Research Instrumentation, Inc. (CRI, inc.) Wobum, Mass., una de las compañías interesadas en el desarrollo de nuevos instrumentos para su aplicación en los estudios anatomopatológicos, expuso, sin dar muchos detalles sobre las características del nuevo equipo para los estudios por análisis multiespectral (7).
Hoy la morfología es la columna vertebral de la patología tradicional, a menudo, vía la inmunohistoquímica ligada a la expresión de, típicamente un marcador singular. Sin embargo, la expresión de un solo marcador no puede decirnos de la complejidad de procesos que están ocurriendo en la célula y está claro que es la célula la real unidad primaria del tumor. No es el tumor el que metastatisa, es la célula y lo que ocurre en ella lo que determina dar el salto.
El otro lado de la moneda, que hoy está causando gran excitación es la capacidad de analizar múltiples genes y decenas o miles de proteínas, pero a expensas de la perspectiva morfológica. No sabemos de donde vienen estos factores. Si de una o varias células, y si es que hay interacción o no entre ellas y cómo. Un tema mayor en estos interrogantes es la interrelación entre el epitelio y el estroma.
En medio de este maremagno de preguntas, el autor se propone mostrar aquí la capacidad de medir 5, 6 ó 7 de estos múltiples factores en juego dentro del campo de acción y de interpretación de una célula singular.
El autor remarca que no es mucho lo que se ha avanzado en la técnica microscópica desde el siglo XVIII. Con el microscopio de Leehwenhook (1700) se obtenía magnificaciones de x295. Con esta magnificación más la hematoxina (1850) más la eosina (1875) y el formol (1890) podemos hoy, con un microscopio convencional, manejar el 90% de lo que se hace ahora.
Las técnicas de coloración permitieron elaborar nuestra concepción celular y armar todo el tinglado para la interpretación de lo que llamamos nuestro conocimiento de la enfermedad. Tuvieron que pasar 50 años (1940) para que identificáramos a las proteínas (inmunoinfluorescencia directa) y otros 30 años para llegar al ADN (1970). Por último llegamos a las computadoras (1990). Aquí subraya lo vulnerable que somos los patólogos como especialidad: Aceptamos que el conocimiento sobre las acciones de un montón de genes nos permiten entender mecanismos de alteración. ¿Cómo obtenemos ese conocimiento?: por intermedio de una biopsia o espécimen tisular. ¿Es esto nuestro trabajo esencial?; no necesariamente, continúa. Les cuento. Un grupo de la Universidad de Stanford tomó imágenes estandar de un cáncer del hígado por Tomografía Computarizada y midieron una serie de características: tamaño, bordes, densidad, homogeneidad de áreas de necrosis, quistes, etc. de las radiografías, y las correlacionaron con las expresiones de los datos de un "array" (8) de ADN y así solo las imágenes tomográficas fueron capaces de captar el 80% de las variaciones en la expresión genética. (Seagal E., Serlin CB, Vol C, et. al. decoding global gene expresions programas in liver cancer by noninvasive imagin. Nat Biotechnol 2007; 25:675-680).
Las expresiones de los "arrays" (8) requieren de alguna forma de material tisular. Lo que tenemos que hacer es revalorar la biopsia. Solo evaluamos 1 ó 2 marcadores por sección. Que saquemos de ella un mayor número de informaciones sobre lo que ocurre a nivel molecular. En los estudios actuales nosotros averiguamos que en tal tumor hay ER, PR y K.67, en tres láminas o secciones diferentes, pero sabemos si son en las mismas células (??). ¿Cuál es la interrelación de esos marcadores en la célula???. Tenemos que mejorar el valor informativo de la biopsia.
Un segundo factor es la evaluación de la intensidad y porcentaje de las reacciones. Hoy lo hacemos subjetivamente y esta expuesto a error. Claro que podemos mejorar con las imágenes digitales, pero esto requiere un "software" sofisticado y muchos cuidados en el procedimiento tecnológico: la computadora nos puede decir muchas cosas que parecen creíbles.
¿Qué hacer entonces? Hay que ampliar las capacidades de la microscopía que usamos. Hay nuevas técnicas ópticas que pueden darnos respuestas con o sin el uso de tinciones especiales. Por ejemplo, el autor expone el caso de la demostración del tejido conectivo (estromal) usando una tecnología que no describe, pero que dice tener en su laboratorio en Cambridge Research Instrumentation, Inc. (CRI, Inc.) (Subborn, Mass). Ilustra una sección de hígado con un nódulo degenerativo rodeado de fibrosis (Fig. 1), detectada por su birrefringencia que aparece de color verde, en una sección ordinaria teñida con H-E. Me parece un asunto interesante pero la ausencia de otras explicaciones, indica un interés crematístico y eso no habla bien del autor, ni de la revista que ha aceptado el artículo.
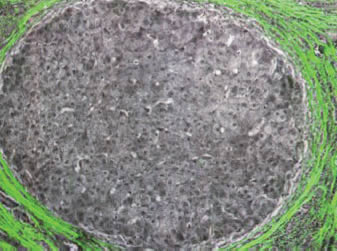 |
Figura 1. Una imagen con el nuevo sitema óptico de
un espécimen teñido con H-E. Se vé un nódulo
regenerativo hepático. La imagen monocrónica es la
convencional del espécimen. La imagen verde que es
material birrefringente, colágeno en ese caso. No se ha
usado otra coloración.
(Arch. Pathol. Lab. Med. 2008; 132:755). |
Imágenes Multiespectrales
Aquí si el autor es más explícito.
Definición: La diferencia entre información espectral e información de color, es que la primera es independiente del observador y la segunda es intrínseca a la experiencia humana, el color es una construcción humana -cuando el hombre vio el primer Arco Iris en el cielo le puso un nombre a cada una de las zonas distintas que veía-. Así, amarillo puede indicar varias cosas: una distribución singular de onda luminosa al separar la luz con un prisma o la mezcla de la luz verde con la luz roja.
Estas dos luces amarillas son espectralmente diferentes pero indistinguibles para el ojo humano y de hecho para una cámara RGB (red - green - blue). Esto explica cómo la imagen multiespectral puede ayudar a distinguir entre, digamos, tejido autofluorescente verde brillante y la fluorescencia verde obtenida con un marcador fluoresceina verde. En el ejemplo del autor "ambas son verdes pero espectralmente son diferentes".
El instrumento multiespectral (CRI's) (Fig. 2) puede ser acoplado sobre cualquier microscopio y con algunos ajustes se puede acomodar a plataformas automáticas de escaneo.
 |
Figura 2. Cámara multiespectral. la Nuance Spectral
Omagin System, montada en un microscopio
ordinario. (Arch. Pathol. Lab. Med. 2008; 132:750). |
¿Qué podemos hacer con este instrumento? Uno de los más importantes logros es la capacidad de permitir más información de una simple marcación inmuno-histoquímica o de múltiples marcaciones al separar los diferentes colores aún cuando ellos estén montados ("overlaps"). El autor muestra una marcación con citokeratina en un ganglio en el que la citokeratona (forma metastásica) es roja y el CD3 marrón. En la foto se ve cordones de células rojas y grupos de células pequeñas marrones, con fondo de células azules pequeñas (hematoxilina). Nada espectacular, pero multiespectralmente podemos separar cada señal: como la coloración de fondo es con hematoxilina se aprecia fácil y claramente las otras tinciones (roja y marrón; cada una por su espectro). No se observa evidencia de cruce entre los marcadores. Además podemos poner en conjunto los diferentes grupos de células marcadas singularmente usando un pseudo color y que también transmiten la imagen al microscopio de luz al modo fluorescente (entiendo que son las bondades del instrumento, que aquí no las detalla). Me imagino que usando canales apropiados se obtienen estos efectos. El hecho es que en las imágenes fotográficas que muestra, cada grupo celular se ve nítidamente con un color
diferente!!!
Porqué el "multiplexing" es útil? Es realmente diferente el poder monitorear eventos moleculares en base al análisis célula por célula. La bondad del instrumento es, deduzco de las fotos, lo que permite comprobar la existencia de coexpresión, con el juego de las lentes y colores. Se puede así identificar un subgrupo de cánceres que coexpresan RE y RP y hacer correlaciones clínicas. Se pueden hacer otras exploraciones. Por ejemplo se puede marcar tres "pathways" del ciclo celular p21, p27 y K.67, con tres marcadores ordinarios marrón, rojo y azul, al microscopio de luz y luego hacer el estudio espectral con el instrumento. ¿Cuántos cromógenos se pueden simultáneamente explorar? todavía no sabemos nos dice el autor. Sin embargo, nos cuenta que un "colega" decidió teñir una sección con tres tipos de cromógenos rojos AEC, liquid remanent Red y Nova red (formas comerciales). Si bien estudiadas en su espectro normal, fueron "pretty similar", con el análisis multiespectroquímico pudieron verse distintos luego que se uso un "redisplay" con pseudocolor inducido.
Esto nos indica que si podemos separar tres variantes de rojo, nos quedan todavía los canales azul y verde, para estudiar otros factores multiespectralmente. Hay, sin embargo, un límite. Conforme se usen más tinciones de absorción, será menor el número de fotones transmitidos y la muestra será difícil de interpretar, aún intentando expresar el resultado en forma de cálculo espectral cuantitativo.
Como existe esta limitación en el número de cromógeenos que pueden usarse con confidencia, hay una tendencia a utilizar la fluorescencia en la patología. La fluorescencia provee la chance para hacer "multiplexing" de más alto nivel por medio de "marcas puntuales quanticas" ("quantum dots") o similares marcadores fluorescentes.
Potencialmente se puede permitir el uso de protocolos más sencillos que los necesarios en la inmunohistoquímica convencional por que se pueden usar directamente entidades conjugadas, de tal manera que si uno expone el tejido a una mixtura de anticuerpos marcados, sobre una lámina, ya consiguió la condición, en su primera etapa. Después puede lavar la lámina si quiere, pero ya está hecho el contacto con los antígenos que se exploraron y solo faltará seguir el proceso.
Se ha subrayado que la fluorescencia tiene más alta sensibilidad que los marcadores usados en la microscopía de luz y que proporcionan mejor trazo lineal y registro dinámico. ¿Por qué los Patólogos no usan a menudo la fluorescencia?
1º La autofluorescencia de los tejidos fijados es un problema. Los tejidos fijados autofluorecen verde - amarillo y esto interfiere con lo que queremos estudiar.
2º Blanqueo rápido. La señal se evanece mientras la estás observando.
3º Los microscopios de fluorescencia son caros y de manejo complejo.
4º Las láminas no se archivan.
5º Las láminas marcadas para fluorescencia no se parecen a sus contrapartes teñidas con H-E.
Parte de estas limitaciones se pueden contrarrestar usando el sistema multiexpectral.
El autor muestra un ejemplo de ganglio linfático teñido con cinco diferentes "quantum dots" + una marcación DAPI (4'6 diamidino-2-fenilindol) para contraste nuclear (Fig. 3). La muestra consiste mayormente en un centro germinal con un área pequeña de celulas del manto. El instrumento fue dispuesto con un solo tipo de longitud de onda de excitación y un tiempo menor a veinte segundos. El instrumento bota un espectro en curvas correspondientes a los colores citocromáticos. Se logra distinguir los 5 colores de los "dot quantum" Azul (K.67), amarillo (CD4), Rojo (CD20), verde (Ig) D, macrófagos color "cyan".
 |
| Figura 3. Imagen espectral "multiplexing". La muestra es un ganglio linfático mostrando un centro germinal (con una pequeña región del manto en la parte superior izquierda), se logra distinguir los cinco colores de los "dot quantum": Azul, (K.67), Amarillo (CD4), Rojo (CD20), Verde (igD), macrófagos color "cyan". (Arch. Pathol. Lab. Med. 2008; 132:750). Cortesía de Chris van der Loos, University of Amsterdam). |
Histocimetría basada en láminas
El Doctor MD. Feldman de la División de Patología Quirúrgica del Sistema de Salud de la Universidad de Pensylvania y sus colaboradores vienen trabajando en una nueva tecnología de imágenes digitales, el desarrollo de softwares para manejarlos y en protocolos de tinción. Han denominado a este procedimiento como Histocitometría basada en láminas (9). Puede compararse, en sus principios básicos, a la citometría de flujo, aunque es mucho más lenta. No se trata de un sistema que pretenda reemplazar al patólogo sino de ampliar su funcionalidad. Está dirigido a lograr mediciones precisas con gran reproducibilidad y hacer cosas que el ojo humano no puede hacer (captar múltiples anticuerpos usando el aditamento para la visión espectográfica “multiplex antibodies”) pero utilizando, a su vez, todo lo que sabemos y hemos aprendido con nuestra microscopia ordinaria de luz.
Nos proponemos aquí relatar sus hallazgos y comentar sobre los futuros alcances de las nuevas tecnologías propuestas.
En el laboratorio del doctor Feldman el problema surgió cuando se trató de cuantificar los efectos de las drogas usadas como terapéuticas. Emitir datos, tratando de mesurar efectos como necrosis y decir 3+ ó 2+ no nos resuelve nada por la subjetividad de la apreciación cualitativa. Se requiere otra modalidad de evaluación. Todos sabemos lo relativo que es el “scoring” en las pruebas de inmunofluorescencia o inmunohistoquímica. El factor cansancio del observador y la limitación de la capacidad de trabajo en 8 horas.
Podemos considerar la histocitometría como un método de análisis con varios eslabones. El primer paso fue la decisión de aplicar la inmunohistoquímica usando como equipo la plataforma de Nuance de los instrumentos CRI (CRI, Inc. Woburn, Mass.). Amant Madhabushi, PhD, del Renssea Polytechnic Institute (Troy N.Y.) está desarrollando una máquina para visionar algorítmicamente los eventos de segmentación celular y subcelular. En conjunto estas armas de procesamiento de las imágenes nos permitirán encontrar regiones de un tumor en un campo dado visual y allí localizar una o varias señales de anticuerpos en una célula y también su localización subcelular, que nos informará del papel biológico que juegan en el proceso.
Otro colaborador Youngmoo Kim PhD, de Drexel University (Philadelphia) ha desarrollado un algoritmo procesador de datos para análisis y exposición siguiendo un sistema que se usa actualmente en citometría de flujo.
Otra novedad que han introducido es un mecanismo para substraer parte del “background”. Hoy hacemos esta substracción subjetivamente (¿qué es reacción real, qué artefacto?). En el sistema por ellos ingeniado se hace con mediciones citométricas.
Los protocolos requieren una tinción secuencial con bloqueo entre el uso de cada anticuerpo primario. Seguido por secuencias adicionales de tinción con otros anticuerpos. Algunas de estas tinciones pueden colocalizarse y esto es una limitación. La tinción de tres blancos (“target”) en el mismo compartimiento espacial y tratar de diferenciarlos espectralmente no ha sido posible, hasta el momento, subrayan los autores.
Nuestro sistema actual, dicen los autores, permite la tinción y separación espectral de dos anticuerpos en un compartimiento así como teñir múltiples compartimentos distintos. De tal manera que podemos hacer 2 en una membrana y 2 sobre un núcleo, 2 sobre la membrana y 2 sobre el núcleo. Esto da una significativa habilidad para interrogarnos sobre las vías patológicas en juego en el contexto del estudio morfológico.
Intentar hacer este tipo de tinción multiplex con solo el uso del ojo humano es un esfuerzo fútil. La imagen aparece turbia, una mezcla de colores imposible de separarse y menos de cuantificarse. Solo se puede hacer una apreciación de adivinanza. Este es un ejemplo en donde la histocitometría actúa como una “ayudante” del patólogo permitiéndole proveer información que de otro modo no se hubiese podido obtener.
Diferentes cromógenos que usamos actualmente en el laboratorio tienen diferentes perfiles espectrales y eso permite usar uno de los “multiplexed immunohistochemical experiments” y separar el cromógeno individual una vez que se conoce cuál es el color espectral para cada cromógeno (Fig. 4).
 |
Figura 4. Las curvas espectrales de una variedad de cromógenos usados en pruebas unmunohistoquímicas según las imágenes producidos por el "Nuance Multiespectral Sistema de Imágenes de Cambridge Research and Instrumentation, Inc.". |
¿Una vez que se ha realizado la tinción y obtenida la información espectral?, ¿cómo se localiza la información a los objetivos blancos?. Actualmente lo que se hace es dibujar las áreas o campos de nuestro interés. Así, localizamos la zona tumoral. Vemos entonces lo que corresponde a la infiltración linfocitaria y lo que es el segmento neoplásico.
En este esfuerzo de segmentación los autores subrayan que vienen usando lo que llaman “modelo de clasificador Bayesian”. Este modelo comienza con la digitalización total de la lámina, esto es, obtener una “lámina virtual”, con el equipo Aperio de “scanning” (Vista California). Luego se hace todo el procedimiento ordinario que hoy sigue el patólogo al estudiar una lámina. Analizamos el preparado histológico panorámicamente (x2, x4) y luego a distintas magnificaciones hasta formarnos una idea si hay o no tumor y si hay, dónde y cuál extensión alcanza. Si por ejemplo estamos frente a un caso de cáncer de próstata solemos usar un clasificador Gleason para identificar los patrones 3, 4 ó 5. Usando la máquina de visión podemos ver las regiones tumorales y una vez comparte- mentalizadas podemos localizar las señales de anticuerpos en las células y en regiones subcelulares. El patólogo ve facilitado su trabajo de búsqueda y segmentación. Con la lámina totalmente digitalizada se pueden presentar las imágenes a la magnificación que uno desee y podemos (la máquina tiene el sistema) aplicar los algoritmos para enfocar solo las áreas con mayor posibilidad de lesiones. Extraemos la información usando “scale-based representation”. Así podemos a baja magnificación preguntarnos sobre si la lesión es o no un cáncer. Identificamos esas áreas basados en la forma, textura y color y luego pasamos a una magnificación mayor, donde aplicamos otro set de filtros y un diferente set de texturas, y estamos ya en otro espacio de estudio. En realidad este es el proceso que hacemos con nuestro cerebro cuando estudiamos una lámina en condiciones ordinarias. Lo que conseguimos con la máquina es que sea ella la que con su sistema computarizado haga, con los datos métricos captados, el proceso de “machine learning” y nos exponga los segmentos distintos que nos interesan definir.
El patólogo extrae ciertas características de su observación microscópica con diferentes aumentos y así llega a una conclusión, por ejemplo en el caso de la próstata, de que se trata de un Gleason 3, 4 ó 5. El resultado final de una máquina con clasificación algorítmica permite un análisis más objetivo y con mejor reproducibilidad.
Los autores creen que este sistema puede generalizarse a diferentes enfermedades así como puede ocurrir con el MIDAS, el aparato desarrollado por Cambridge Research and Instrumentation, Inc. (CRI, Inc.) que es también una máquina configurada para utilizar algoritmos.
Se puede intentar utilizar el sistema frente a una imagen compleja (“hiker”), frente a imágenes de Carcinoma de la próstata, o de la mama. Los autores piensan que vamos a ver que, para cada uno de estos ejemplos, se van a desarrollar algoritmos, quizás no un modelo único común a todos, sino más bien algoritmos específicos para cada enfermedad. Estos diferentes modelos se aplicarán para las rutinas de segmentación. ¿Cuál es el mejor algoritmo?. Es algo que todavía no podemos decir. ¿Será mejor el MIDAS o el Bayesian?. O de repente un híbrido de los dos. Quizás hay algunas características del algoritmo de Bayesian que se puedan adicionar al algoritmo de CRI de MIDAS.
La conclusión es que la visión a través de la máquina (“machine vision”) va a ser capaz de proveer una segmentación de alta calidad. No creemos que vaya a ser un sistema perfecto pero si estamos trabajando con un aparato que nos da un 95% de seguridad objetiva, ¿qué importa si hay unas cuantas células que no han entrado en la cuenta? Se trata de un equipo y un “software” altamente funcional y útil.
Una vez que la “máquina de visión” o la “segmentación manual” han identificado el área tumoral, usamos un set de algoritmos para identificar los núcleos. Los autores subrayan que ellos cuentan con un set especial de algoritmos para identificar membranas celulares al lado de los núcleos. Una vez que se ha identificado núcleos y membranas celulares, se obtiene el citoplasma por substracción. Esta combinación de elementos mesurados (células, núcleos, membrana y citoplasma con la intensidad de tinción en cada región) es exactamente el tipo de información que uno requiere para generar una base de datos que pueda representarse gráficamente como se hace en la citometría de flujo.
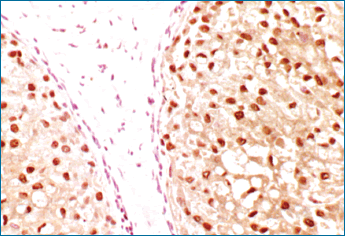
La figura 5 es un ejemplo de una lámina de Cáncer de mama teñida para ERK fosforilada. Después de hacer la segmentación de imagen, determinado todos los núcleos, en la segmentación manual, los datos pueden convertirse en un histograma (Fig. 6). En lugar de 1+ y 2+ tenemos un conjunto de datos para trasladar y una más fina gradación de la intensidad de valores para comparar.
La figura 7 es otro ejemplo de lo que se puede obtener analizando los hallazgos con un solo anticuerpo. Estos son datos de un ensayo clínico en plena ejecución en la Universidad de Pennsylvania, estudiando una droga que está dirigida contra una vía proteinokinasa activada (MAP, mitogen activated protein). Lo que queremos saber es ¿está haciendo efecto la droga?. Observando si el tumor se agranda o disminuye por “in vivo radiology imagen”, sin duda, obtenemos una idea o aproximación, pero en realidad lo que queremos saber es si la señal de la MAP - kinasa activada antes de suministrar el tratamiento, tuvo algún efecto después del mismo. Esto es la fosforilización ERK antes de la terapia y después de ella, y vemos, por el resultado en el histograma, que podemos observar una dramática diferencia y en esta forma tenemos una modalidad de monitorear el tratamiento.
Lo que se está tratando de hacer es de crear un sistema objetivo y cuantificable que nos permita medir los efectos de los ensayos terapéuticos localizando cambios a nivel celular o subcelular independientes del factor subjetivo que se nos impone cuando simplemente, como hacemos ahora leemos nuestras láminas. Solo el 40% de los pacientes HER-2 positivos responden al tratamiento con trastuzumab. ¿Por qué?. El doctor Feldman y su grupo han comenzado a estudiar el problema y vienen encontrando que hay poblaciones de células tumorales positivas al HER-2 y poblaciones negativas en el mismo tumor. Y lo mismo ocurre con RE y RP. La figura 8 nos da una idea del camino que siguen estas investigaciones.
|
 |
Figura 5. Un caso de "Cáncer in situ" de mama teñido con ERK fosforilada (pERK). La imagen superior muestra el aspecto con la visión ordinaria rojo, verde, azul, con las células tumorales positivas en núcleo y citoplasma y ausencia de positividad en las células del estroma adyacente.
El panel inferior muestra el aspecto RGB después de la captura espectral de la imagen y la localización de los núcleos positivos con (pERK) en amarillo y los núcleos negativos en gris. |
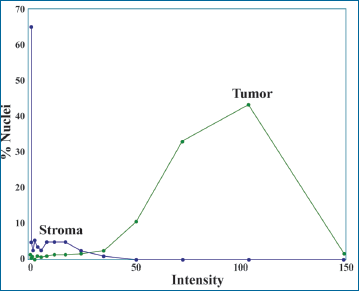 |
| Figura 6. Histograma de distribución de Tinción nuclear de la imagen en la figura 5. Se muestra el histograma de distribución de la intensidad de la tinción de ERK fosforilado (pERK) en las células tumorales, en color verde y las células estromales, en color gris-azulado. |
 |
Figura 7. Ejemplo de aplicación práctica del uso del sistema citométrico.
En este experimento, un paciente ha recibido un inhibidor de la Kinasa proteínica activadora de la mitosis, para el tratamiento del cáncer y se estudian muestran teñidas para pERK antes y después del tratamiento.
Las muestras del paciente antes y después de la terapia se analizaron histocitométricamente y los resultados antes (azul) y después (verde) se exponen lado a lado demostrando una gran reducción en pERK después de la terapia con el inhibidor de la proteinokinasa activadora de la mitosis. |
 |
Figura 8. Un caso de tumor de mama con triple positividad a HER2, RE y RP. El análisis con el “multiplexed immunohistochemical stain” con el análisis espectral muestra que hay dos poblaciones de células tumorales, una que es HER-2 positiva y negativa para RE y RP, y una segunda población que es HER-2 negativa y RE y RP positiva.
|
Análisis proteómicos
Hace cinco años el doctor Robert Brown, del Beisinger Medical Center, (Danville, Pa.) fundó el Servicio de Consultas de Análisis Proteómicos. Él estaba interesado en el estudio de las denominadas "Señales de Transducción de las vías patológicas" ("Signal transduction pathways"), esto es, el reconocimiento de cómo los receptores de superficie transmiten la información dentro de la célula (los pasos del lenguaje celular): hormonas, neurotransmisores, factores de crecimiento, compuestos endógenos y exógenos (“ligands") que se unen a receptores, extra o intra celulares, proteínas que representan, en la mayoría de los casos, la primera etapa del proceso de reacción intracelular que conducirá, en última cuenta, a una respuesta biológica específica. Su interés se centraba en el rol que el patólogo clásico podía o debía jugar en la identificación de estas vías. Él tomó conciencia que el patólogo estaba bien situado para emprender esta empresa. El patólogo ve el tumor, sus células, tiene una perspectiva sobre su estructura, su relación con vasos, estroma y células vecinas, su homogeneidad relativa o su heterogeneidad. Consiguió algunos probadores de estas señales de transducción y así comenzó su trabajo. Hoy el Dr. Brown ostenta la silla Harvey S. Rosenberg de Patología y Medicina de laboratorio como Profesor de la University of Texas Medical School en Houston, el primer servicio en morfoproteómica.
La consulta proteómica ofrece hoy la esperanza a los pacientes cuyos tumores no han respondido al tratamiento, y convierte a los patólogos en colaboradores en las decisiones a tomar en el paciente individual. Esto es, jugar un rol en la “medicina personalizada” (6).
Consideremos el caso de un tumor al que le interrumpimos una de las vías de convergencia; el tumor se puede adaptar e intentar una vía alternativa o utilizar otras señales, más allá de la vía interrumpida. Sin embargo, en morfoproteómica hemos elegido el observar las señales moleculares de convergencia del modelo transduccional y sabemos que la mayoría de las TirosinaKinasas convergen en esa vía. De tal manera que si la morfoproteómica nos permite identificar la vía activada sabremos qué vía mayor está operando en el tumor. Se usa entonces probadores fosforoespecíficos dirigidos contra los sitios putativos de la activación de las moléculas de las señales de transducción y así usando esos probadores fósforo específicos seremos capaces de determinar si es que la proteína analizada es o no fosforilada (10).
También la morfoproteómica puede evaluar la com-parmentalización de una molécula activada. Esto es, esta molécula se expresa ¿en el citoplasma?, ¿en la membrana celular? o ¿en el núcleo?. Por ejemplo, el Perk1/2 es una molécula que requiere ser translocada al núcleo para ser activada en la señal de la transducción. Igualmente, si la proteína KinasaC(PKC)-alfa es translocada a la membrana celular, sabemos que está activada. ¡Muy bien! Están activadas, pero qué es lo que hacen?. Buscamos entonces el ciclo celular, fácilmente con probadores adecuados sabremos si la célula está en ciclo celular. Si no está, entonces toda la terapia dirigida contra la fase del ciclo celular es dinero gastado por gusto. Seguimos investigando las vías de quimio-resistencia y analizamos si ellas están constitutivamente activadas y también si hay expresión correlacionada de otras moléculas que están asociadas con el estado de activación de la vía patológica.
En la forma que acabamos de comentar, el patólogo pasa de ser un simple clasificador de una lesión a un activo participante en la toma de decisiones terapéuticas de cada paciente individual.
Finalmente, la telepatología robótica permitirá que cada uno de estos avances puedan ser consultados en tiempo real, con los mejores especialistas en el mundo (11). Gracias al auspicio de la Compañía APERIO Technologics Inc. de California llevamos a cabo una experiencia de Telepatología Robótica con los Laboratorios de Patología de la Escuela de Medicina de la Universidad Federal de Sao Paulo, Brasil, en el Hospital Británico de Buenos Aires, Argentina y el Instituto de Patología y Biología Molecular Arias-Stella de Lima, Perú. Actuó de coordinador y consultor el Dr. Juan Rosai del Centro Consulenze Anatomia Patologica Oncologica, Centro Diagnostico Italiano (CDI). La Compañía APERIO instaló y adiestró para el manejo de los equipos y mantuvo operativa la central de datos de SecondSlideTM. En un período de 5 meses se consultaron 69 casos. El experimento “SecondSlideTM Pilot Proyect” de APERIO resultó exitoso y la experiencia ganada proporcionó el conocimiento necesario para hacer que el SecondSlideTM esté listo para operar globalmente (12).
Bibliografía
- Mellors RC. Analytical Cytology. 2nd Edition. Mc. Graw-Hill Book Company. 1959.
- Weinstein RS. The S-Curve Framework. Predicting the Future of Anatomic Pathology. Arch Pathol. Lab. Med. 2008;132:739-742.
- O’Malley DP. Practical Applications of Telepathology using Morphology-Based anatomic Pathology. Arch. Pathol. Lab. Med.2008;132:743-747.
- Kass ME. The future escape of Pathology. Conference. Introduction. Arch. Pathol. Lab. Med. 2008;132:733.
- Schwartz JN. The future escape of Pathology. Conference. Overview. Arch. Pathol. Lab. Med. 2008;132:734.
- Friedman BA. A survey of the Myriad Forces Changing Anatomic Pathology and their consequences. Arch. Pathol. Lab. Med. 2008;132:735-738.
- Levenson R. Putting the "more" back in Morphology. Spectral Imaging and Image analysis in the Service of Pathology. Arch. Pathol. Lab. Med. 2008;132:748-757.
- Arias-Stella J. De la Patología Celular a la Molecular (de diablos y magia al Proteoma) - Parte II. Folia Dermatológica Peruana 2002;13(2):48.
- Feldman M. Beyond Morphology. Whole slide Imaging. Computer-AIded Detection, and Other Techniques. Arch. Parhol. Lab. Med. 2008;132:758-763.
- Ford Anne. For pathologisys, the future arrives this June, CAP TODAY 22, 2008;4:5-8.
- Arias-Stella J. Telehispatología Diagnóstica. Viabilidad de una forma de Telemedicina en nuestro medio. Diagnóstico 2002;41(2): Falta numeración de páginas.
- Arias-Stella Castillo J, Valdes-Gomez J, Yance-Chávez T, Arias-Stella J. Primera Experiencia de Patología Robótica en el Perú. En publicación. Marzo 2009.
1 Profesor Emérito de la Universidad Peruana Cayetano Heredia. Director Instituto Patología y Biología Molecular Arias-Stella. |
