Terapia biológica en el manejo del cáncer
Franklin Aldecoa Bedoya (1)
Introducción
Un producto biológico o biofarmacéutico, es una medicina cuyo principio activo es elaborado o derivado de un organismo vivo, reemplazando o suplementando una proteína natural producida en el cuerpo humano. Obviamente, tales agentes son más complejos que las drogas químicas tradicio-nales, en su estructura, método de sedicamentos biológicos como cualquier substancia producida por organismos vivos, que es usada en la prevención, diagnóstico o tratamiento del cáncer. Las drogas biológicas incluyen citoquinas, anticuerpos monoclonales y vacunas. Sin embargo, la definición más apropiada de estos productos anticancerígenos es que son “productos biotecnológicos”, pues estas proteínas son derivadas de la tecnología de recombina-ción del ADN y de la técnica del hibridoma. La tecnología del ADN recombinante o ADN recombinado, se basa en incorporar el gen humano de una proteína conocida, a través de una molécula de ADN artificial formada in vitro, a una célula hospedera. Esto se hace a través de diferentes técnicas de biología molecular, para que dicha célula produzca cantidades importantes de dicha proteína. La producción de una proteína no presente en un organismo determinado y producidas a partir de ADN recombinante se llaman proteínas recombinantes. La técnica del hibridoma se usa básicamente para la obtención de anticuerpos monoclonales (1-4).
A) CITOQUINAS
Las citoquinas son proteínas de bajo peso molecular que usualmente son mediadores químicos que actúan en un rango corto, entre células vecinas. Han sido estudiadas extensamente en los pasados 30 años. Estas moléculas que anteriormente recibieron distinta nomenclatura como interleuquinas, interferones, factores de crecimiento, etc. están comprometidas en muchos procesos biológicos esenciales, como la proliferación celular, proceso inflamatorio, inmunidad, migración, fibrosis, reparación y angiogénesis Estas moléculas están asociadas a receptores, los cuales generan señales intracelulares para procesos fundamentales, de tal forma que no sorprende que algunas alteraciones en las citoquinas, sus receptores o en las señales de transducción que se generan, estén comprometidas en el cáncer. Las citoquinas más usadas como tratamiento directo del cáncer son: el interferón alfa y la interleuquina 2. Otras citoquinas están siendo usadas como medicamentos de soporte medular, debido a la toxicidad hematológica de la quimioterapia anti-neoplásica: factores estimulantes de colonias de granulocitos/monocitos y la eritropoyetina (5-7).
Interferon alfa
Los interferones fueron las primeras citoquinas en ser descubiertas por Isaacs y Lindenmann en 1957; el nombre fue sugerente, luego de que se percataran que después de una infección viral, había una sustancia que interfería con la infección de otras células, esta sustancia fue llamada “interferón”. Subsecuentemente, se sabe que la mayoría de las especies son capaces de sintetizar este compuesto; en el ser humano se producen al menos 3 tipos de interferones: alfa, beta y gama, son producidas por distintas células e incluyen un rango amplio de actividades biológicas, como son: la induc-ción de resistencia celular a virus, regulación de la función inmune y regulación del crecimiento y diferenciación de muchos tipos celulares. Los interferones tipo alfa y beta tienen en promedio un 30% de homología y se unen al mismo receptor, induciendo actividad biológica similar, siendo por estas razones conocidos como interferones de tipo I; en cambio el interferon gama es evolutivamente distinto y tiene un rango diferente de actividad biológica (interferon tipo II). Por muchos años se asumió que el interferon alfa (IFN-a) era producido con un solo gen, sin embargo, ahora sabemos que existe al menos 24 genes o pseudogenes relacionados, que codifican para 16 interferones alfa maduros distintos, pero que en general comparten un 70% de homología y estructura terciaria similar. Se han reportado remisiones de la enfermedad con el uso del IFN-a en pacientes con leucemia de células peludas, una forma rara de leucemia de células B y en leucemia mieloide crónica, sin embargo, en la actualidad existen medicamentos más efectivos que han desplazado a los interferones en estas patologías. El IFN-a puede ser usado actualmente en el tratamiento del cáncer renal de células claras, en conjunción con medicamentos biológicos, logrando respuesta objetivas y de supervivencia muy buenas (8-12).
Inteleuquina 2 (IL-2)
La IL-2 es un polipéptido de 133 aminoácidos, también conocida como el factor de crecimiento de las células T, ya que juega un rol central en la respuesta inmune, como consecuencia de la activación antigénica o mitógena de los linfocitos T (sobre todo los linfocitos “helper”). La IL-2 induce actividad biológica a través de un receptor específico de membrana, el cual se encuentra frecuentemente expresado en las células inmunes. La inmunoterapia del cáncer con IL-2 ha demostrado actividad importante en algunos pacientes con cáncer renal metastático y en melanoma maligno avanzado. Sin embargo, con la introducción de los nuevos medicamentos anti-neoplásicos con actividad inhibitoria de tirosina cinasa, moléculas inmunomodulatorias, y vacunas para el tratamiento del cáncer, existe un interés incrementado en la combinación de estos medicamentos con la IL-2 (9,13).
Factores estimulantes de colonias
Los factores estimulantes de colonias (FEC), también llamados factores de crecimiento hematopoyético, regulan la producción por la médula ósea de glóbulos rojos, glóbulos blancos y plaquetas circulantes. Los FEC actúan sobre las células madre y originan la diferenciación específica hacia cada linaje. El factor de las células madre (FCM) regula la diferenciación de las células madre CD34+ aunque otros factores modulan la síntesis de tipos celulares más específicos: la eritropoyetina (EPO) para los glóbulos rojos; el factor estimulante de colonias de granulocitos (FEC-G) para los neutrófilos; el factor estimulante de colonias de granulocitos-macrófagos (FEC-GM) para macrófagos y neutrófilos; el factor estimulante de colonia de macrófagos (FEC-M, también llamado factor estimulante de colonias 1 [FEC-1]) para los monocitos; y trombopoyetina (TPO) para la maduración de megacariocitos y la síntesis plaquetaria. La EPO controla la síntesis de glóbulos rojos y ha estado disponible de forma recombinante desde 1985; se ha utilizado para el tratamiento de la anemia en los pacientes con nefropatía terminal, mielodisplasia y para el tratamiento de la anemia inducida por el tratamiento del cáncer. El FEC-G y FEC-GM actúan sobre las células madre hematopoyéticas (CD34+) para regular la proliferación y diferenciación del progenitor de los neutrófilos/macrófagos. Se usan sistemáticamente para movilizar las células madre en las personas normales, para el trasplante de células madre, en pacientes con neoplasias malignas hematológicas o en los mismos pacientes, para mejorar la toxicidad hematológica por quimioterapia (neutro- penia) (14).
B) ANTICUERPOS MONOCLONALES
Dentro de la inmunidad adaptativa, la inmunidad humoral mediada por anticuerpos es importante para neutralizar y/o eliminar microbios extracelulares o toxinas a través del reconocimiento antigénico de los linfocitos B. Sin embargo, los anticuerpos pueden elaborarse ahora en el laboratorio para diagnosticar y tratar el cáncer. Para crear anticuerpos monoclonales, los científicos primero inyectan células cancerosas humanas en ratones para que sus sistemas inmunes produzcan anticuerpos contra estas células cancerosas. Los científicos recogen las células plasmáticas de ratón que producen anticuerpos y las unen con células que han crecido en el laboratorio para crear células “híbridas” llamadas hibridomas. Las hibridomas pueden producir indefinidamente grandes cantidades de estos anticuerpos puros. Los anticuerpos monoclonales pueden usarse para el tratamiento del cáncer en diversas formas:
• Los anticuerpos monoclonales que reaccionan con tipos específicos de cáncer pueden mejorar la respuesta inmune del paciente al cáncer.
• Los anticuerpos monoclonales pueden programarse para que actúen contra los factores de crecimiento de las células y así dificultar el crecimiento de las células cancerosas.
• Los anticuerpos monoclonales pueden estar enlazados con fármacos anticancerosos, radioisótopos (sustancias radiactivas), modificadores de la respuesta biológica o con otras toxinas. Cuando los anticuerpos se unen a las células cancerosas, ellos entregan estos conjugados directamente al tumor y así ayudan a destruirlo.
La efectividad y seguridad del uso de los anticuerpos monoclonales en el tratamiento del cáncer ha sido reconocida con excelentes niveles de evidencia, de tal forma que muchos de ellos han sido aprobados por la Food and Drugs Administration of USA (FDA) y la European Medicines Agency (EMA). Los anticuerpo no conjugados son específicos para antígenos expresados por el propio tumor y actúan generando respuesta inmune contra las células que sobre expresan dichas proteínas (citotoxicidad celular asociada a anticuerpos, activación de la cascada del complemento). Existen anticuerpos que reconocen ciertos factores de crecimiento importantes en el inicio y mantenimiento del cáncer, como el Receptor del Factor de Crecimiento Epidermal (EGFR), tipo 1, también conocida como ERBB1 y el tipo 2 ó HER-2 (también conocida como ERBB2), usualmente sobre-expresadas en tumores sólidos. Adicionalmente, existen algunos anticuerpos cuyo blanco fundamental son factores asociados al microambiente tumoral (factores asociados al estroma, que producen factores tumorigénicos), como el caso del Bevacizumab, que bloquea el Factor de Crecimiennto del Endotelio Vascular (VEGF), una molécula formada por las células tumorales o su micro-ambiente, que propicia la formación de nuevos vasos sanguíneos a partir de otros vasos pre-existentes y a partir de ello la nutrición y mantenimiento del tumor e incluso la oportunidad de viajar a otros sectores del organismo (metástasis).
Los anticuerpos conjugados, como aquellos asociados a radioisótopos o agentes quimioterapéuticos han demostrado efectividad sobre todo en el área hematológica (2,15-19) (Tabla 1).
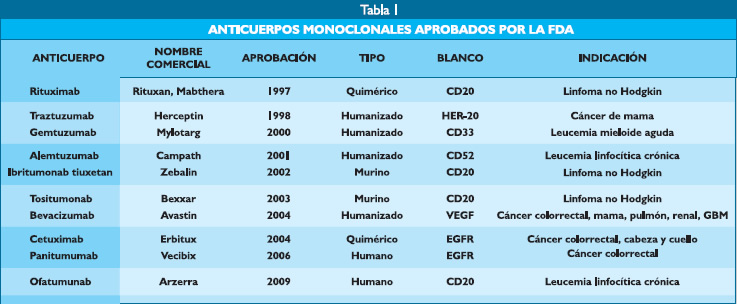 |
|
GBM: Glioblastoma multiforme
|
B.1 Anticuerpos Monoclonales
en neoplasias hematológicas
Rituximab
Rituximab es un anticuerpo monoclonal quimérico (65% proteína humana y 35% murina) producido por tecnología recombinante. Rituximab tiene como blanco el antígeno de superficie CD20 el cual se encuentra en ~95% de todos los linfomas de células B. El uso de distintos esquemas de quimioterapia asociadas al Rituximab es el tratamiento estándar tanto para los linfomas de células B, indolentes como agresivos. El uso de este anticuerpo monoclonal agregado a distintos esquemas de quimioterapia, ha cambiado el comportamiento de la enfermedad, de tal forma que ha aumentado la supervivencia libre de progresión y la supervivencia global en cifras que no se habían visto con la quimioterapia sola, e incluso, genera la esperanza de que el linfoma folicular (linfoma de bajo grado ó indolente), cuya historia final y de largo plazo terminaba con la muerte de la mayoría de los pacientes, ahora tiene una meseta importante en la curva de supervivencia y ya se especula si muchos de estos pacientes que se mantienen sin progresión, estarán curados de la enfermedad (solo el tiempo contestará esta interrogante) (20,21).
Ibritumomab tiuxetan Y90
El Ibritumomab tiuxetan es un anticuerpo monoclonal conjugado al itrio 90, ello significa que un radioisótopo que libera radiación de tipo ß está asociado al anticuerpo, permitiendo que si reconoce el antígeno blanco en las células neoplásicas, irradiará a las células neoplásicas vecinas, permitiendo su eliminación. Este anticuerpo, al igual que Rituximab, reconoce al CD20 como blanco específico y por tanto, está aprobado como segunda línea de terapia en linfoma folicular, después del quimioterapia + Rituximab. Este es un segmento sumamente importante para los pacientes que recurren a pesar de recibir la mejor terapia actual (quimioterapia más rituximab) y a pesar que no podemos hablar de la posibilidad de curación, se prolonga la supervivencia de muchos de los pacientes. La principal toxicidad es medular (neutropenia y trombocitopenia), por lo cual el paciente debe tener al menos > 25% de compromiso medular por el linfoma para ser considerado elegible para esta terapia (22).
Tositumomab 131
Es un anticuerpo monoclonal similar al ibritumomab tiuxetan, pues es un anti-CD20 conjugado al yodo 131. Al igual que el anterior, la dosis limitante está dada por su mielotoxicidad y su dosis debe ser individualizada. El yodo 131 emite radiación beta y gama y la dosis total al paciente es mucho más alta que el ibritumomab tiuxetan. La indicación aprobada es linfoma maligno refractario al tratamiento con rituximab (23).
Alemtuzumab
Alemtuzumab es un anticuerpo monoclonal humani-zado que reconoce al antígeno CD52, el cual es una glicoproteína de membrana, de alta densidad, la cual es expresada en varias de las células inmunes normales. Debido a su amplio espectro de presencia, su mayor toxicidad es inmunosupresión. Alemtuzumab ha sido aprobado por FDA, como primera opción de tratamiento en la leucemia linfocítica crónica. Esta enfermedad es también indolente en muchos casos, pero el final casi siempre es el mismo, una leucemia refractaria al tratamiento que termina con la vida del paciente. Hasta hace no mucho, se usaba solamente quimioterapia que en muchos casos era tóxica o poco tolerada; sin embargo, en el momento actual existen varios anticuerpos monoclonales que funcionan bien en esta enfermedad, incluyendo al rituximab y ofatumumab. Existe evidencia de acción de esta droga en linfo-mas de células T, pero aún se encuentra en investigación (24).
.Gemtuzumab ozogamicin
Es un anticuerpo monoclonal conjugado a una agente antitumoral. El anticuerpo reconoce el CD33, la cual es una proteína que se expresa en la superficie celular de las células mieloides primitivas (blastos), donde se inicia la leucemia mieloide aguda. Está conjugada a la caliqueamicina, la cual es un potente antibiótico antitumoral que ingresa al núcleo y rompe secuencias específicas del ADN. La FDA ha aprobado esta medicación para el uso en leucemia mieloide aguda, en pacientes con 60 ó más años que expresen CD33, después de una primera recaída y que no son candidatos para quimioterapia citotóxica. La toxicidad más importante es la hematológica, caracterizada por mielosupresión con neutropenia febril (incidencias de cuadros infecciosos), sin embargo, se han reportado además, un síndrome veno-oclusivo hepático o sinusoidal obstructivo, el cual puede comprometer la vida del paciente (25).
Ofatumumab
Es un anticuerpo monoclonal humano (sin restos de proteína murina) que reconoce como antígeno o blanco al CD20. Ha sido aprobado por la FDA para el tratamiento de la Leucemia linfatica crónica, refractaria a fludarabina (quimioterapia anteriormente estándar). Esta es una nueva molécula que aumentará la expectativa de mejorar el tratamiento de la leucemia linfática crónica, junto a agentes quimoterapéuticos que han demostrado actividad en esta enfermedad (26).
B.2 Anticuerpos Monoclonales
en neoplasias sólidas
Trastuzumab
El receptor del factor de crecimiento epidermal humano tipo 2 (HER2) es una proteína transmembrana que se encuentra en muchos tejidos epiteliales, es sobre-expresada en 20 - 30% de todos los cánceres de mama. Trastuzumab es un anticuerpo monoclonal humanizado que reconoce al HER2. Este anticuerpo monoclonal está aprobado en conjunción con la quimioterapia, en el tratamiento del cáncer de mama que expresa el HER2, tanto en el tratamiento adyuvante (posterior a una cirugía que no deja evidencia de enfermedad y cuyo objetivo es evitar la recurrencia de enfermedad), en el cual ha demostrado que ha disminuido significativamente la tasa de recaída del cáncer de mama, logrando tasas de curación mucho mayores que la quimioterapia sola, tanto como en el tratamiento avanzado/metastático, donde ha prolongado la supervivencia global de las pacientes y la calidad de vida (27,28). Últimamente, ha sido aprobado para el tratamiento del cáncer gástrico avanzado/metastático, en los pacientes que sobreexpresan el HER2, demostrando que puede aumentar hasta 6 meses la supervivencia global en comparación a quimioterapia sola (29,30)
Bevacizumab
Es un anticuerpo monoclonal recombinante humanizado, sin embargo, su principal acción es bloquear el Factor de Crecimiento del Endotelio Vascular (VEGF), una proteína crítica, segregada por las células tumorales o las células del microambiente tumoral, necesaria para la formación de nuevos vasos sanguíneos (proceso llamado angiogénesis), por lo cual se considera más un antiangiogénico, ya que la acción principal es bloquear el VEGF y no incentivar el sistema inmune para actual sobre el tumor, como en los casos anteriores. La acción de bloquear la formación vascular tumoral, tiene un número de ventajas: a diferencia de los anticuerpos monoclonales clásicos, los cuales se usar muy selectivamente en tumores que expresen la proteína en la superficie celular, en este caso el antiangiogénico puede usarse en distintos tipos de tumor, con toxicidad limitada. Adicionalmente, las células endoteliales no son sujetos de mutación, tan frecuentes en las células tumorales y por ende existe menor posibilidad de resistencia. Bevacizumab ha sido aprobado para el tratamiento del cáncer colorrectal metastático, siempre asociado a la quimioterapia basado en 5-fluorouracilo/leucovorina con irinotecan u oxaliplatino. También ha sido aprobado en el tratamiento del cáncer de mama avanzado/metastático en pacientes que no sobreexpresan HER2, asociados al tratamiento con taxanos. Del mismo modo, ha sido aprobado en cáncer de pulmón de células no pequeñas, sobre todo con histología adenocarcinoma, asociado al tratamiento quimioterápico con dupletas de platino. También es usado en cáncer renal metastático de células claras, en pacientes con bajo o medio riesgo, asociado al uso del interferon alfa. Finalmente y a diferencia de las anteriores indicaciones, donde Bevacizumab está aprobado en primera línea de tratamiento, ha sido considerado como segunda línea, después de recaída a quimioterapia (temozolamida), en el tratamiento del glioblastoma multiforme; la neoplasia del sistema nervioso central, más frecuente en adultos. Los eventos adversos más importantes en los estudios clínicos incluyeron, hipertensión arterial, y proteinuria (29-34).
Cetuximab
Cetuximab es un anticuerpo monoclonal quimérico que reconoce como antígeno al EGFR, el cual es expresado en una gama de tumores de tipo epitelial. Las principales indicaciones de este anticuerpo son en cáncer colorrectal metastático, en el caso que los tumores no hayan mutado en K-ras; en caso contrario, no debiera usarse los inhibidores del EGER. También ha sido aprobado para ser usado en combinación con radiación, para tratar a pacientes con cáncer de cabeza y cuello de células escamosas, en los cuales no puede removerse el tumor por cirugía e incluso ha sido probado con sales de platino, con importantes resultados (35). La toxicidad principal de este medicamento son las reacciones constitucionales a la infusión, así como una dermatopatía tipo acné y diarrea (35,36) .
Panitumumab
Es un anticuerpo monoclonal totalmente humano, que reconoce como antígeno el EGFR. Está indicado en cáncer colorrectal metastático y sus efectos colaterales son compartidos con cetuximab, pero en un grado menor, debido a su condición de anticuerpo humano (37).
C) VACUNAS
El cáncer es generado por una serie de cambios incontrolables a nivel genético, por la acción de diferentes noxas que inciden sobre elementos vitales que regulan y controlan la división y diferenciación celular (oncogenes, genes supresores de tumor, enzimas reparadoras del ADN). Los cambios genotípicos van a condicionar expresión aberrante de las proteínas correspondientes, los cuales a su vez serán reconocidas como extrañas en algún momento de su exposición, al sistema inmune. Basados en estos cambios permanentes es posible esperar que nuestro sistema inmunitario esté permanentemente eliminando células con expresión anómala de proteínas, que por alguna razón han trasgredido el control de las enzimas reparadoras a nivel del núcleo, el punto de vigilancia entre G1-S ó G2-M del ciclo celular y otros sistemas de control celular. Históricamente, se pensó que la mejor inmunidad contra los tumores era mediada por anticuerpos, sin embargo los diferentes ensayos clínicos en animales dieron la respuesta final, que la inmunidad celular era el bastión más importante contra los antígenos tumorales. Los trabajos preliminares de Boon y cols., quienes introdujeron primero la metodología para aislar antígenos reconocidos por los linfocitos T citotóxicos (CTL), originaron que posterior- mente sea aislado el primer antígeno reconocido por CTL, de un paciente con melanoma. Sin embargo es claro que los linfocitos T CD4+ juegan un rol esencial en el rechazo al tumor, especialmente el subgrupo Th-1 el cual realza o extiende la persistencia de las células T CD8+ ó CTL in vivo. Por tanto, la mayoría de las investigaciones se orienta a estimular este último mecanismo, llamado "inmunidad celular". Las células deben reconocer moléculas específicas del tumor (llamados antígenos) y sufrir procesos de activación. Las vacunas fueron inicialmente desarrolladas para la prevención de las enfermedades infecciosas, con gran éxito. Obviamente, muchos de los agentes infecciosos son organismos o tienen componentes muy diferentes a los humanos, y por tanto, es simple alertar al sistema inmunológico humano para que reconozca estos agentes extraños. En este contexto, existen las vacunas preventivas del cáncer, como el uso de la vacuna contra el virus del papiloma humano, que es directo responsable del cáncer de cuello uterino. La situación es mucho más compleja cuando se pretende que ese mismo sistema inmunológico humano pueda discriminar entre dos células humanas, una sana y otra neoplásica; sin embargo, se están desarrollando vacunas para tratar un cáncer ya establecido, estimulando una respuesta inmune contra el tumor, un concepto nuevo en la terapia tumoral, que involucra diferentes área de desarrollo. Las vacunas terapéuticas del cáncer se producen de diversos modos: usando células neoplásicas muertas o frágiles, que transportan antígenos específicos asociados al cáncer o células inmunes modificadas que expresan tales antígenos. Estas células pueden venir del propio paciente o pueden ser tomadas de otros pacientes (vacunas alogénicas). Otros tipos de vacunas terapéuticas para el cáncer son elaboradas usando moléculas del ácido desoxiribonucleico (ADN) o ribonucleico (ARN) que contienen las instrucciones genéticas para traducir antígenos asociados al cáncer. Los científicos han identificado un gran número de antígenos producidos por las células neoplásicas y muchos de ellos aún están en fase experimental. Sin embargo, no basta con tener antígenos selectivos relacionados al cáncer, como substrato para inducir respuestas inmunes que puedan contribuir a controlar el crecimiento tumoral, algunas sustancias son fundamentales para lograr estos resultados, como los llamados adyuvantes. Estas sustancias sirven para realzar la respuesta inmune una vez que el antígeno es expuesto al sistema; estos adyuvantes tienen distintos orígenes, como bacterias [bacilo de Calmette-Guérin (BCG)], sustancias bacterianas (Detox B), productos biológicos derivados de organismos no microbianos, [keyhole limpet hemocyanin (KLH)], o sustancias no biológicas como el aceite emulsificado montanide ISA–51. También se pueden usar algunas citoquinas como adyuvantes: IL-2, INF alfa y el factor estimulante de granulocitos y monocitos. Los avances son cada vez mayores, de tal forma que en abril del presente año la FDA aprobó la primera vacuna terapéutica para el cáncer. Sipuleucel-T (Provenge®, manufacturada por Dendreon), fue aprobada para ser usada en algunos pacientes con cáncer metastático de próstata. Esta vacuna estimula la respuesta inmune en tumores prostáticos que expresan el antígeno: fosfatasa prostática ácida (PAP), el cual está presente en la mayoría de los casos. Muchos estudios clínicos con intervención de las vacunas terapéuticas están en plena investigación, incluyendo aquellas que involucran otras formas de tratamiento multidisciplinario. Probablemente en el futuro, la inmunoterapia será otro gran origen de muchos medicamentos que asociados a los ahora conocidos, nos proveerán de mayores oportunidades de mejorar los resultados del cáncer, sobre todo, en pacientes con enfermedad avanzada (38-46).
Conclusiones
La biotecnología nos ha permitido controlar o curar algunas de las enfermedades más serias conocidas por el hombre. En el mundo, la vida de más de 300 millones de personas ha sido transformada por la disponibilidad de estas nuevas drogas. En la actualidad existen más de 150 medicamentos y vacunas logrados por biotecnología (casi el 10% de los medicamentos aprobados por la FDA). Los medicamentos biotecnológicos en cáncer han sido fundamentales en tratamiento de esta enfermedad, ya que las distintas drogas quimioterápicas en diferentes combinaciones o regímenes, no habían mejorado en las última dos décadas del pasado siglo, las respuestas y supervivencia de los pacientes con cáncer. Sin embargo, con el apoyo de distintas disciplinas científicas como la genética, inmunología y bioquímica, logramos nuevos medicamentos que han cambiado drásticamente la historia natural de la enfermedad. Es posible que en los próximos años, en número de medicamentos biológicos para el cáncer crezca ostensiblemente, sobre todo los anticuerpos monoclonales y vacunas y se estima que en la presente década el 50% de los nuevos medicamentos para el cáncer se lograran con esta tecnología.
Referencias bibliográficas
- EMEA Committee for Medicinal Products for Human Use.Silapo European Public Assessment Report, London, 2007. Available at: http://www.emea.eu.int.
- NCI [National Cancer Institute (EEUU)]http://www. cancer.gov/cancertopics/ treatment/biologicaltherapy.
- Schellekens H.Follow-on biologics: challenges of the ‘next generation’. Nephrol Dial Transplant 2005;20(Suppl 4):iv31-iv36.
- Aldecoa F, Battilana C. Genomica y proteomica: Un paso más. Acta Med Per 2006;23(3).
- Vilcek J, Feldmann M.Historical review: cytokines as therapeutics and targets of therapeutics. Trends Pharmacol. Sci. 2004;25:201-209.
- Oppenheim JJ.Cytokines: past, present, and future. Int. J. Hematol. 2001;74:3-8.
- Feldmann M. Many cytokines are very useful therapeutic targets in disease. J Clin Invest. 2008;118(11):3533-3536.
- Isaacs A, Lindenmann J.Viral interference. The interferon. Proc R Soc Lond B Biol Sci 1957;147:258-267.
- Walsh G.The citokines -the interferon family-, in Biopharma-ceuticals: Biochemistry and Biotechnology. Second Edition. Wiley 2003.
- Quesada JR, Hersch EM, Gutterman JU.Hairy cell leukemia: induction of remission with alpha interferon. Blood 1983;62:207a.
- Talpaz M, McCredie KB, Mavligit GM, Gutterman JU.Leukocyte interferon-induced myeloid cytoreduction in chronic myelogenous leukemia. Blood 1983;62:689-692.
- Escudier B, Pluzanska A, Koralewski P, et al.Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: A randomised, double-blind phase III trial. Lancet 2007;370:2103-2111.
- Antony G, Dudek A.Interleukin 2 in Cancer Therapy. Current Medicinal Chemistry 2010;17:29:3297-3302.
- Bennett C, et al.Use of Hematopoietic Colony-Stimulating Factors: Comparison of the 1994 and 1997 American Society of Clinical Oncology Surveys Regarding ASCO Clinical Practice Guidelines. JCO Nov 1, 1999:3676-3681.
- Abbas A.Humoral Immune Responses; in Basic Immunology. Saunders Elsevier. 3ra edición. 2009.
- Aldecoa F. Anticuerpos monoclonales como terapia antineoplásica. Anales de la Facultad de Medicina UNMSM. 2001;62:31-43.
- Weiner L, et al.Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews | Immunology 2010; 10:317-327.
- Boyiadzis M, et al.Approved monoclonal antibodies for cancer therapy. Expert Opin. Biol. Ther. 2008; 8:1151-1158.
- Oldham RK, Dillman RO.Monoclonal antibodies in cancer thera- py: 25 years of progress. J Clin Oncol. 2008;26(11):1774-1777.
- Coiffier B, et al.CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-b-cell lymphoma. N. Engl. J. Med. 2002;346:235-242.
- McLaughlin P, et al.Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolente lymphoma: half of patients respond to a four-dose treatment program. J. Clin. Oncol.1998;16:2825-2833.
- Witzig TE, et alRandomized controlled trial of yttrium-90-labeled ibritumomab tiuxetan radioimmunotherapy versus rituximab immunotherapy for patients with relapsed or refractory low-grade, follicular, or transformed b-cell non-Hodgkin’slymphoma. J. Clin. Oncol. 2002;20:2453-2463.
- Kaminski MS, et al.Radioimmunotherapy with iodine 131I tositumomab for relapsed or refractory b-cell non-Hodgkin lymphoma: updated results and long-term follow-up of the University of Michigan experience. Blood. 2000;96:1259-1266.
- Lundin J, et al.Phase II trial of subcutaneous anti-CD52 monoclonal antibody alemtuzumab (Campath-1H) as first-line treatment for patients with b-cell chronic lymphocytic leukemia (b-CLL). Blood 2002;100:768-773.
- Sievers EL, et al.Selective ablation of acute myeloid leukemia using antibody-targeted chemotherapy: a phase I study of an anti-CD33 calicheamicin immunoconjugate. Blood 1999;93:3678-3684.
- Wierda WG, et al.Ofatumumab as single-agent CD20 immunotherapy in fludarabine-refractory chronic lymphocytic leukemia. J. Clin. Oncol. 2010;28:1749-1755.
- Vogel CL, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J. Clin. Oncol. 2002;20:719-726 .
- Slamon DJ, et al.Use of chemotherapy plus a monoclonal antibody against HER2 for metastático breast cancer that overexpresses HER2. N. Engl.J. Med. 2001;344:783-792.
- Bang Y, Van Cutsem E, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. The Lancet, 2010;376:687-697.
- Hurwitz H, et al.bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorrectal cancer. N. Engl. J. Med. 2004;350:2335-2342.
- Miller K, et al.Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N. Engl. J. Med. 2007;357:2666-2676.
- Sandler A, et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N. Engl. J. Med. 2006;355:2542-2550.
- Escudier B, et al.Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet 2007;370:2103-2111.
- Vredenburgh J, et al.Bevacizumab Plus Irinotecan in Recurrent Glioblastoma Multiforme. J. Clin. Oncol. 2007;25:4722-4729.
- Vermorken JB, et al. Predictors of efficacy in the EXTREME study: Cetuximab plus platinum-based therapy first line in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck (SCCHN). N Engl J Med 2008;359:1116-1127.
- Rougier P, et al.Addition of cetuximab to FOLFIRI in first-line metastatic colorectal cancer (mCRC): updated survival data and influence of KRAS status on outcome in the CRYSTAL study. Presented at the American Society of Clinical Oncology 2009 Gastrointestinal Cancers Symposium, San Francisco, January 15-17, 2009.
- Amado R, et al.Wild-Type KRAS Is Required for Panitumumab Efficacy in Patients With Metastatic Colorectal Cancer. J. Clin. Oncol. 2008;26:1626-1634.
- Boon T, van der Bruggen P.Human tumor antigens recognized by T lymphocytes. J. Exp. Med. 1996;183:725-729.
- De Plaen E, Lurquin C, van Pel A, et al.Immunogenic (tum-) variants of mouse tumor p815. Cloning of the gene of tum- antigen P91A and identification of the tum- mutation. Proc. Natl. Acad. Sci. USA 1988;85:2274-2278.
- Van der Bruggen P, Traversari C, Chomez P, Lurquin C, et al.A gene encoding an antigen recognized by cytolytic T lymphocy-tes on a human melanoma. Science 1991;254:1643-1647.
- Zajac AJ, Murali-Krishna K, Blattman JN, Ahmed R.Therapeutic vaccination against chronic viral infection: the importance of cooperation between CD4+ y CD8+ T cells. Curr. Opin. Immunol 1998;10:444-449.
- Saslow D, et al.American Cancer Society Guideline for Human Papillomavirus (HPV) Vaccine Use to Prevent Cervical Cancer and Its Precursors. Cancer J Clin 2007;57:7-28.
- Larsen S, et al.Therapeutics cancer bacines. Current Cancer Therapy Reviews. 2010;6:163-174.
- Tang D, Devit M, Johnston SA.Genetic immunization is a simple method for eliciting an immune response. Nature 1992;356(6365):152-154.
- Parmiani G, et al. Opposite immune functions of GM-CSF administered as vaccine adjuvant in cancer patients. Annals of Oncology 2007;18:226-232.
- Kantoff PW, Higano CS, Shore ND, et al.Sipuleucel-T immunotherapy for castration-resistant prostate cancer. New England Journal of Medicine 2010;363(5):411-422.
(1) Médico Oncólogo, Miembro de La Sociedad de Oncología Médica. Director Médico de Merck Peruana.
|
