ENFERMEDADES METABÓLICAS DEL HUESO
Metabolismo normal y patológico del tejido óseo
Fausto Garmendia Lorena (1)
Metabolismo normal
Los huesos en los mamíferos, incluyendo a la especie humana, constituyen un sistema que cumple diversas funciones, tales como de sostén y movimiento corporales, de protección de estructuras como el cerebro, médula espinal y órganos del tórax; la médula ósea roja participa en la hematopoyesis y, así mismo, poseen un metabolismo muy activo de recambio de calcio y fosfatos en los procesos de formación y resorción ósea. De acuerdo a su arquitectura se reconoce a un hueso compacto o cortical más denso y duro y un hueso esponjoso o trabecular, cuya proporción varía de acuerdo a los diferentes segmentos del cuerpo; así, la diáfisis de los huesos largos se caracteriza por poseer hueso compacto, en tanto que las vértebras, cráneo, esternón, pelvis y la epífisis de los huesos largos contienen una mayor cantidad de hueso esponjoso, lo que tiene relación con el tipo de fracturas que pueden sufrir por agentes físicos (1).
Los huesos contienen una matriz proteica, fundamental u osteoide y células que cumplen diferentes funciones. La matriz orgánica está formada por fibras de colágeno inmersas en la sustancia fundamental y un componente inorgánico en forma de hidroxiapatita de calcio. La sustancia fundamental consta de un componente glucósido formado por sialoproteínas y proteoglucano (condroitinsulfato y ácido hialurónico).
En la matriz proteica cristalizan las sales de calcio dentro de un ordenamiento determinado en forma genética. En el hueso compacto la cristalización se halla dispuesta en forma de laminillas circunferenciales externas, laminillas circunferenciales internas, sistema de los conductos de Havers u osteonas, comunicados por los conductos de Volkmann y laminillas intersticiales; en tanto que el hueso esponjoso se halla dispuesto en forma de trabéculas y cavidades vasculares.
Los osteoblastos son células de forma cuboide o poliédrica, dispuestas en una capa, son formadores de hueso al secretar colágeno y la sustancia fundamental que constituyen el hueso inicial no mineralizado u osteoide; así mismo, son responsables de la calcificación de la matriz mediante la secreción de pequeñas vesículas que contienen gran cantidad de fosfatasa alcalina. Mediante prolongaciones celulares forman un sistema celular entre osteoblastos y osteocitos. El osteocito es un osteoblasto maduro, de forma aplanada, está rodeado por la matriz ósea y es responsable de mantener su capacidad de sintetizar y resorber la matriz. De acuerdo a su actividad se dividen en osteocitos latentes, formativos y osteocitos resortivos.
El osteoclasto es una célula multinucleada de gran tamaño, que descansa directamente sobre la superficie ósea, cuya función es la resorción ósea con la formación de excavaciones inmediatamente debajo del cuerpo celular, poco profundas, llamadas lagunas de resorción.
La actividad de formación ósea de los osteoblastos requiere de 3 a 4 meses para completarse, y la de resorción ósea de los osteoclastos, se lleva a cabo tan solo en 3 semanas, ambas están en un equilibrio permanente de remodelación ósea, que varía en función de la edad y el género. En los primeros años de vida hasta los 20 años existe un mayor proceso de formación ósea. Entre los 20 a 30 años se alcanza la mayor formación en términos de la cantidad de masa ósea. Después de esa edad se produce una disminución progresiva de la masa ósea. Con la declinación de función ovárica, a partir de la menopausia, las mujeres sufren una disminución mucho mayor que los varones que las pone en mayor riesgo de osteopenia y osteoporosis.
El proceso de remodelación ósea normal es regulado por factores sistémicos y factores locales. Los factores sistémicos comprenden por un lado a las hormonas parathormona (PTH), calcitonina, esteroides gonadales y suprarrenales, insulina, tiroxina y somatotropina y, por otro, a la vitamina D3, D2, el calcio y los fosfatos (2,3).
La PTH mantiene la calcemia mediante el incremento de la resorción ósea, de la reabsorción tubular renal de calcio y de la absorción intestinal de calcio estimulando la hidroxilación renal de 1,25-vitamina D; su secreción aumenta cuando desciende la calcemia y disminuye cuando esta aumenta. La calcitonina es la hormona secretada por las células C de la glándula tiroides, cuya secreción se incrementa por el aumento de la calcemia y tiene el efecto de disminuirla, al frenar la resorción ósea y la reabsorción tubular renal de calcio. Los andrógenos de las glándulas gonadales masculinas, femeninas y de las suprarrenales, los estrógenos, insulina y somatotropina tienen un efecto anabólico favorable a la formación de la matriz proteica del hueso y no dependen de las fluctuaciones del calcio extracelular. La tiroxina en condiciones normales favorece el crecimiento y la maduración ósea durante la niñez y adolescencia
La vitamina D tiene dos componentes, el ergocalciferol (D2) que ingresa al organismo con los alimentos y el colecalciferol (D3) que se produce en la piel por la acción de la luz solar sobre el 7-dehidrocolesterol; ambas se activan a través de una hidroxilación en el hígado y otra en el riñón transformarse en 1,25(OH)2-vitamina D o calcitriol, que finalmente es la forma activa. Esta transformación se produce por estímulo de la PTH. La vitamina D estimula la absorción intestinal de calcio, manteniendo los niveles normales de calcemia y contribuyendo a la normal mineralización del hueso. Es así mismo muy importante el aporte de calcio al organismo, los alimentos ricos en calcio son la leche y sus derivados.
Los factores locales de la regulación de la remodelación ósea están representados por las células óseas que, como se mencionó más arriba, constituyen una red mediante sus prolongaciones celulares que las intercomunica e interactúa a manera de un sistema de interrelación paracrina, mediante moléculas pertenecientes a la familia de las moléculas “ligadoras” (ligands) del factor de necrosis tumoral (TNF) como el RANKL (Receptor Activator for Nuclear Factor Kappa B Ligand), que se encuentra en la superficie de membrana de osteoblastos, células del estroma y linfocitos T, siendo estos últimos los únicos con la capacidad demostrada de secretarla. Su principal función es la activación de los osteoclastos. Los efectos del RANKL están mediados por su unión al RANK que es un receptor celular altamente específico. La administración parenteral de RANKL recombinante en ratones provoca osteoporosis severa asociada a un aumento de la actividad osteoclástica, pérdida ósea rápida y severa hipercalcemia. En contraste, ratones deficiente en RANKL desarrollan una severa osteopetrosis, provocada por un gran déficit de osteoclastos.
La Osteoprotegerina (OPG), también miembro de la superfamilia de receptores del TNF, es un factor soluble segregado por los osteblastos. Se interpone al RANKL neutralizándolo, al ocupar e impedir su unión con el RANK. Inhibe la diferenciación, sobrevida y fusión de los precursores de osteoclastos, bloquea la activación de los osteoclastos maduros e induce a su apoptosis (4). Los osteoclastos para diferenciarse y madurar deben tener contacto directo con los osteoblastos e interrelacionar mediante la unión al receptor del ligando presente en las respectivas membranas celulares. Si hay suficiente OPG en el medio se unirá al RANKL de los osteoblastos impidiendo su interacción con el RANK de los precursores osteoclásticos con lo que se inhibe el proceso de activación osteoclástica.
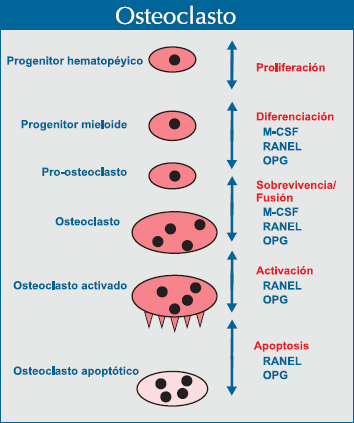 |
| Figura 1. Diferenciación del osteoclasto. |
En la figura Nº 1 se aprecia la evolución del osteoclasto desde la célula progenitora, su diferenciación, activación y apoptosis (adaptado de Aubin JE y Bonnelye E(4)).
La PTH, vitamina D3, glucocorticoides, PGE2 e IL-11 y otras hormonas, reguladoras del Ca++ y citoquinas estimulan la osteoclastogénesis a través de la doble acción de inhibir la producción de osteoprotegerina y estimulando la producción de RANKL. Por el contrario los estrógenos actúan inhibiendo la producción de RANKL.
La producción de OPG es estimulada por las citoquinas proinflamatorias, IL 1 , IL 11, FNT á y â, TGF â, estrógenos y Ca++, mientras que la PG E2, GCC, calcitriol y PTH la disminuyen.
La concentración de las hormonas que regulan el metabolismo del calcio determina la dirección del recambio óseo, pero los factores locales modulan el efecto final y, a su vez, modifican la concentración de las hormonas y la respuesta biológica a nivel de los osteoblastos y los osteoclastos.
Patología general del metabolismo óseo
De acuerdo a la definición de Albright y Reifenstein (5), las enfermedades metabólicas del hueso son alteraciones que comprometen, en más o menos, todo el tejido óseo del organismo debido a disturbios del control humoral del metabolismo óseo; bajo este concepto, por lo tanto, se debe considerar a la osteoporosis, osteomalacia, raquitismo, osteitis fibroquística del hiperparatiroidismo y a la osteopetrosis como enfermedades metabólicas del hueso.
La osteoporosis se caracteriza por una disminución de la masa ósea, deterioro de la micro arquitectura, fragilidad y susceptibilidad a las fracturas (6).
La osteomalacia es la alteración metabólica sistémica del adulto, caracterizada por una disminución de la mineralización ósea. Esta misma entidad nosológica en el niño se denomina raquitismo (7).
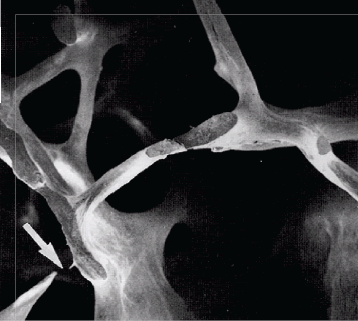 |
| Osteoporosis |
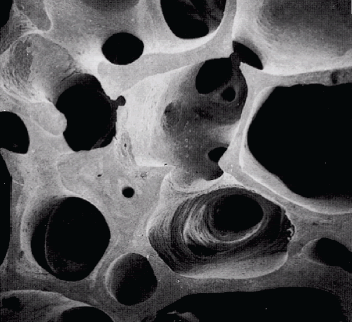 |
| Normal |
El hiperparatiroidismo se caracteriza por el incremento de la producción de la PTH, que puede ser autónomo de las variaciones de la concentración de calcio como en el hiperparatiroidismo primario, terciario y ectópico o ser la consecuencia de una disminución de la disponibilidad de calcio como en el hiperparatiroidismo secundario. En las diferentes formas de hiperparatiroidismo se produce un incremento de la actividad osteoclástica con gran resorción ósea, acompañada de fibrosis y focos de neoformación ósea (8,9) .
En el presente simposio no se describirá a la osteopetrosis, enfermedad de aparición extremadamente rara, hereditaria, caracterizada por incremento anormal de la densidad ósea (hueso marmóreo), talla corta, fracturas patológicas, hipocalcemia con crisis de tetania, pancitopenia, producida por deficiencia de la maduración o de la actividad osteoclástica de origen genético (4,10).
Referencias Bibliográficas
- Archila M. Histología del tejido óseo. www.monografías/ trabajos26/histología-osea/histologia-osea.shtml
- Montenegro SD, Pedroza IJ, Vargas ES, Ramos MH.Metabolismo óseo: Actualización. Rev Postgrado IV Cátedra de Medicina 2002;17:18-21.
- Lanham-New S.Nutritional Influences on Bone Health: An Update on Current Research and Clinical Implications. Medscape Ob/Gync & Women´s Health, 2006.
- Aubin JE, Bonnelye E. Osteoprotegerin and its Ligand: A New Paradigm for Regulation of Osteoclastogenesis and Bone Resorption. Medscape General Medicine. 2000;2(2).
- Albright F, Reifenstein EC Jr.The parathyroid glands and metabolic bone disease. Williams and Wilkins, Baltimore, 1948.
- Nelson HD, Haney EM, Dana T, Bougatsos Ch, Chou R. Screening for Osteoporosis: An Update for the U.S. Preventive Services Task Force. Ann Intern Med 2010;153:99-111,
- Francis RM, Selby PL. Osteomalacia. Baillieres Clin Endocrinol Metab 1997;11:145-163.
- Garmendia F. Manual de Endocrinología Clínica. Segunda Edición. Capítulo Cuarto. Enfermedades Paratiroideas. Servicios Médicos y Tecnológicos SRL, Lima, 1993.
- Saliba W, El-Haddad B. Secondary hyperparathyoidism: Pathophysiology and treatment. J Am Board Fam Med 2009; 22: 574-581.
- Stark Z, Savarirayan R. Osteopetrosis. Orphanet J Rare Dis. 2009; 4:5-22
1 Miembro Permanente del Instituto de Investigaciones Clínicas, Facultad de Medicina de la Universidad Nacional Mayor de
San Marcos (UNMSM); Presidente de la Academia Nacional de Medicina. |
