21 años de la re-emergencia del Dengue en el Perú: una enfermedad crónicamente anunciada
César Cabezas Sánchez (1)
Resumen
El dengue es un problema creciente para la salud pública en las áreas tropicales del mundo incluido el Perú, es producido por el virus del dengue con 4 serotipos y transmitido por el mosquito Aedes aegyptque convive con los humanos. La presencia del vector se ve favorecida por deficientes condiciones sanitarias y sociales. La cada vez más frecuente cocirculación de los 4 serotipos y la aparición de nuevos genotipos como el Asiático/Americano del serotipo 2, están condicionando formas severas de la enfermedad como el choque y sangrado. El reciente cambio de la clasificación de la enfermedad como dengue (con o sin signos de alarma) y Dengue severo, está contribuyendo a un diagnóstico y tratamiento más oportunos permitiendo salvar muchas vidas mediante la administración de soluciones cristaloides. Es importante destacar la necesidad de la vigilancia de casos febriles y los índices aédicos para un control también oportuno del vector mediante educación sanitaria y manejo ambiental con participación comunitaria e intersectorial. Una alternativa de prevención complementaria sería la vacunación utilizando vacunas tetravalentes cuya seguridad y eficacia están aún en evaluaciones clínicas.
Palabras clave:Dengue, control Aedes aegypt, infecciones reemergentes.
ANTECEDENTES Y EPIDEMIOLOGÍA
El dengue es un problema creciente para la salud pública en las áreas tropicales del mundo. En la región de las Américas el patrón es similar a la situación que se observó en Asia hace 30 años, siendo actualmente el dengue la enfermedad viral transmitida por mosquitos, más importante que afecta a los seres humanos.
En las últimas dos décadas en la Américas se ha objetivado una creciente incidencia de casos con picos epidémicos cada vez mayores que se repiten cada 3 a 5 años casi de manera regular en los países. Particularmente en el primer trimestre del 2011 hay una actividad intensa del dengue en los países de esta Región, habiéndose registrado hasta la semana 9 de este año 206,097 casos de dengue con una tasa de incidencia de 39.4x100,000 habitantes; 2,744 casos graves, 223 fallecidos con una tasa de letalidad promedio de 8.1, hechos que han determinado la implementación de planes de control locales y nacionales, debiendo resaltar que el 96% del total de casos en las Américas y el 100% de los fallecidos en lo que va del año corresponden a lo ocurrido de los países de Sudamérica (1).
La carga de enfermedad expresada en años perdidos por discapacidad (DALYs) es de 0.42 x 1000 habitantes lo cual es semejante a la meningitis, el doble de hepatitis y un tercio de HIV/Sida. En el Sudeste Asiático y Pacífico Occidental las tasas de ataque llegan a 6400 x 100000 habitantes y allí - durante décadas - los niños constituyeron hasta el 95% de los casos, lo cual ahora ha cambiado y existe un discreto predominio de adultos, tal como estaba ocurriendo en Brasil y otros países suramericanos (2).
En el Perú, los primeros reportes de brotes de un síndrome febril compatible con dengue clásico, fueron descritos en 1700, 1818,1850 y 1876, aunque no se tuvo confirmación laboratorial (3). La introducción del dengue en el Perú en el siglo XX está ligado a la reintroducción del Aedes aegypt. Este vector, luego de su eliminación en el Perú en 1956 reingresó en 1984, haciendo inminente el ingreso del dengue, lo cual ocurrió el año 1990 con la ocurrencia de una explosiva epidemia de dengue clásico debido al serotipo 1 del virus dengue, en las principales ciudades de nuestra Amazonía y que posteriormente se extendió a las ciudades de la costa norte del país (4,5) y en la actualidad, prácticamente todas las áreas con presencia de Aedes aegypt, presentan casos de dengue y la circulación de cuatro serotipos de dengue.
La emergencia o reemergencia del Dengue en los diferentes países y en las diversas regiones dentro de los países, obedecen a la presencia de varios determinantes y una combinación de los mismos, como son: el cambio climático, la escasa disponibilidad de agua para consumo, el crecimiento poblacional sostenido, las intensas migraciones de áreas endémicas a áreas no endémicas de dengue, la urbanización no controlada ni planificada, viviendas inapropiadas en centros urbanos, inadecuada disposición de residuos, uso cada vez mayor de envases no biodegradables en el medio así como neumáticos en desuso, el inadecuado saneamiento ambiental, tránsito urbano, interprovincial y aéreo intenso. Igualmente destacar la aún deficiente coordinación intersectorial y la poca participación de organizaciones y población, por considerar que el problema del dengue es un problema del sector salud.
El vector y la transmisión Dengue
El Aedes aegypt, originario de África, es el vector transmisor del dengue, pero también de la fiebre amarilla urbana (FAU). En 1881 Carlos Finlay propuso la teoría de que Ae. aegypti transmitía la FAU (6). En las Américas durante 1920 se llegó a controlar; en el año 1965, 17 de 49 naciones lo erradicaron, pero en 1980 Bolivia se reinfestó, en 1981 Paraguay y en 1984 la región amazónica del Perú (7). Actualmente la mayoría de los países de las Américas están infestadas por el vector del Dengue. El Aedes aegypt, se encuentra distribuido en las principales ciudades de la Amazonía y la costa norte del Perú, desde Tumbes hasta Lima (8).
Las transmisión del dengue se produce a través de la picadura del mosquito Aedes aegyptlos que pican durante el día. La presencia del virus en los pacientes hasta el 5 día de fiebre, hace que el mosquito pueda infectarse, y este mosquito se torna infectante de 8 a 12 días después de alimentarse con sangre y así continúa durante toda su vida (45 días). Hay un período de incubación de 5 a 7 días desde la picadura del mosquito hasta la aparición de síntomas en las personas infectadas (Figura 1).
 |
| Figura 1. Transmisión del virus de dengue por Aedes aegypti. |
El Aedes aegypt, pasa por 4 estadios evolutivos, que incluyen desde huevo, larva, pupa y adulto. Luego de emerger de la pupa, el insecto se posa sobre las paredes del recipiente durante varias horas hasta el endurecimiento de sus alas y su exoesqueleto (Figura 2).
 |
Figura 2. Estadios evolutivos del Aedes aegypti:
Huevo, larva, pupa y adulto. |
Dentro de las 24 horas, después de la emergencia, puede ocurrir el apareamiento. El macho es atraído por el sonido emitido por el batir de las alas de la hembra durante el vuelo. Las hembras se alimentan de la mayoría de vertebrados, pero prefieren a los humanos, vuelan en sentido contrario al viento y son atraídas por los olores y gases del hombre. La sangre sirve para el desarrollo de los huevos.
Después de cada alimentación se desarrolla un lote de huevos. Si la hembra completa su alimentación sanguínea (2 - 3 mg) desarrollará y pondrá 100-200 huevos, el intervalo dura de dos a tres días. La hembra grávida buscará recipientes oscuros o sombreados para depositar sus huevos, prefiriendo aguas limpias y claras. La hembra no sobrepasa los 50-100 m durante su vida (puede permanecer en la misma casa donde emergió). Si no hay recipientes, una hembra grávida puede volar tres kilómetros para poner sus huevos. Los machos se dispersan menos que las hembras. Descansan en lugares sombreados como alcobas, baños, patios o cocinas. Se les captura sobre ropas colgadas, debajo de muebles, toallas, cortinas y mosquiteros.
Los adultos pueden permanecer vivos en el laboratorio durante meses y en la naturaleza pocas semanas. Con una mortalidad diaria de 10%, la mitad de los mosquitos morirán durante la primera semana y 95% en el primer mes.
El Aedes aegypt, se encuentra en casi cien países tropicales y se calcula que 2,5 billones de personas en el mundo habitan en áreas donde existe el riesgo de transmisión de la epidemia (1). En la figura 3 se puede apreciar la dispersión del Aedes aegypten las Américas.
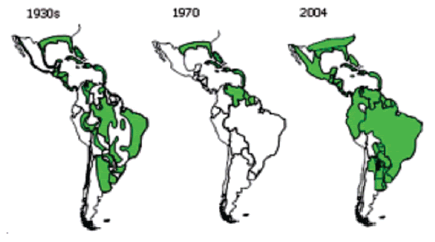 |
Figura 3. Evolución de la dispersión del Aedes en las
Américas Fuente: OPS. |
En nuestro país, este vector está disperso en la costa norte y la mayoría de ciudades de la Amazonia, como se muestra en la figura 3. En Lima existen 27 distritos con localidades infestadas, entre los que se encuentran: Comas, Rímac, San Martín, Los Olivos, Independencia, Puente Piedra, Carabayllo, Cercado, La Victoria, Ancón, Jesus María, San Luis, Ate, Santa Anita, Lurigancho, Chaclacayo, El Agustino,
San Juan de Lurigancho, La Molina, Villa El Salvador, Villa Maria del Triunfo, San Juan de Miraflores, Surco, Callao, Carmen de La Legua, Ventanilla y San Antonio de Chaglla (9).
 |
| Figura 4. Distribución del Aedes aegypti en el Perú |
El Aedes aegyptes un mosquito que reside dentro o en el peridomicilio, se cría en recipientes sombreados y con agua limpia, en los cuales las hembras depositan sus huevos por encima del nivel del líquido, en las paredes de dichos recipientes. En lugares lluviosos, como la selva, los recipientes predilectos son los objetos desechados como llantas, latas, botellas o floreros, o cualquier recipiente que mantenga el agua de lluvia; en lugares no lluviosos como en Lima y la costa, son los recipientes caseros para almacenar agua como barriles, tanques bajos y altos, tinajas y baldes, sobre todo en lugares donde no hay acceso al agua (Figura 5).
 |
| Figura 5. El Aedes aegypti requiere de agua limpia para su reproducción, las condicionantes en zonas lluviosas como la amazonía (A) y en el zonas como Lima donde no hay lluvias (B), pueden diferir pero conllevan los mismos riesgos para su proliferación. |
Otro vector asociado a la transmisión del dengue es el Aedes albopictus, en el cual puede ocurrir la transmisión vertical, o sea que una vez infectado con el virus del dengue, puede transmitir a otras generaciones del mosquito sin requerir picar nuevamente a una persona infectada, lo cual dispersaría más rápidamente la infección. Actualmente aún no se ha descrito a este vector en el país.
El virus
El virus del dengue es un arbovirus («arbo» acrónimo del inglés arthropod borne, transportado por artrópodos) y pertenece al género de Flavivirus familia Flaviviridae un grupo de más de 68 agentes virales agrupados por su relación serológica y por la determinación de secuencias genómicas; al menos 30 de estos virus causan enfermedad en los humanos (10,11).
La partícula viral del dengue es de forma esférica y mide entre 40 y 60 nm de diámetro. Tiene una envoltura formada por proteínas [proteína E (principalmente), y proteína M] que cubre completamente la superficie del virus (Figura 5). El material genético se encuentra protegido por una nucleocápside circular de simetría poliédrica; el diámetro del núcleo es de 25-30 nm. Entre la envoltura y la nucleocápside se encuentra una bicapa lipídica, cuyos lípidos se derivan de la membrana celular del hospedero. El genoma está compuesto por una sola molécula de RNA de cadena sencilla lineal, de sentido positivo, de 10703 nucleótidos y de alta variabilidad genómica.
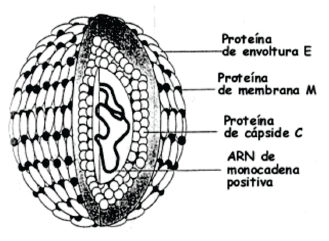 |
Figura 6. Virus del dengue y sus compentes.
|
El grupo virus dengue está representado por cuatro serotipos 1, 2, 3 y 4: los cuales tienen características antigénicas y serológicas diferentes, además pueden presentar variantes genéticas (genotipos y topotipos) dentro de un mismo serotipo, relacionadas con la virulencia y la procedencia geográfica de la cepa (12,13). Así tenemos el
serotipo dengue 1 tiene cuatro genotipos, el serotipo dengue 2 tiene seis genotipos (Americano, asiático 1 y 2, Asiático/americano, selvático), el serotipo dengue 3 tiene cuatro genotipos y el serotipo 4 también cuatro genotipos. La incidencia anual del dengue desde su ingreso al Perú en 1990 hasta el 2011 y los serotipos circulantes en el país se puede apreciar en la figura 7.
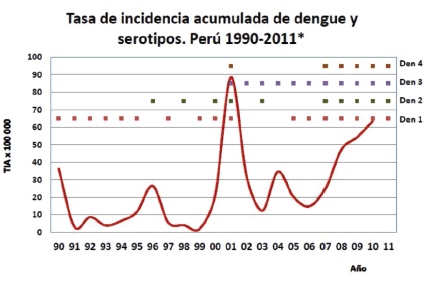 |
| Figura 7 |
El año 1990 ingreso al Perú el serotipo 1, desde ese año han circulado los cuatro serotipos de manera individual o conjunta en los diferentes años, durante este año 2011 circulan los serotipos 1, 2, 3 y 4. Debemos destacar que a fines del 2010 ingresó al país el genotipo americano/asiático correspondiente al serotipo 2 de dengue, el cual fue identificado por el Instituto Nacional de Salud (14). Este genotipo en años anteriores estuvo asociado a casos severos tanto en Venezuela como Brasil (15) lo cual se ha podido constatar en el Iquitos, donde la epidemia que se inició a fines del 2010 y progresó en el 2011 fue de carácter explosivo, con un desmesurado numero de hospitalizados y un número de fallecidos asociados a dengue, nunca antes regis-trado desde el ingreso del dengue al país en 1990. Es importante destacar la complejidad que significara la respuesta clínica que podría estar asociados a las variantes genotípicas de los diferentes genotipos.
Aspectos clínicos y la nuevas definiciones de caso
Las manifestaciones clínicas en el dengue tienen un amplio espectro, desde las formas inaparentes o febriles con dolores de cuerpo hasta las más severas con choque o hemorragia.
Es importante destacar que debido a problemas en la clasificación del dengue hemorrágico y su manejo, la OMS (16) ha recomendado una nueva clasificación que se ajusta más a los hallazgos clínicos, así tenemos el a) Dengue (sin o con signos de alarma) y b) Dengue severo (Figura 8). Esta nueva clasificación permite un mejor manejo de los casos.
Debe sospecharse dengue en toda persona con fiebre o antecedente de fiebre dentro de los 7 días antes de la consulta, que vive o procede en zonas donde se ha reportado Dengue y/o está infestada por Aedes aegypt, que adicionalmente presente dos o más manifestaciones como: cefalea, dolor retro ocular, mialgia y/o artralgia, rash cutáneo, sangrado espontaneo en piel o prueba de torniquete positiva. En el proceso debe tenerse en cuenta los signos de alarma y detectar tempranamente el dengue severo.
Entre los signos de alarma destacan el dolor abdominal intenso y continuo, vómitos persistentes, acumulación de fluidos clínicamente detectables, sangrado en mucosas, letargia o irritabilidad, hepatomegalia mayor a 2 cm y en el laboratorio aumento del hematocrito y reducción del número de plaquetas.
Actualmente es más aceptado que la diferencia entre lo que se llamaba dengue clásico y dengue hemorrágico es la presencia de extravasación de plasma, más que la hemorragia, que clínicamente se puede manifestar por la colección de líquidos en cavidades serosas, como el derrame pleural, ascitis y derrame pericárdico.
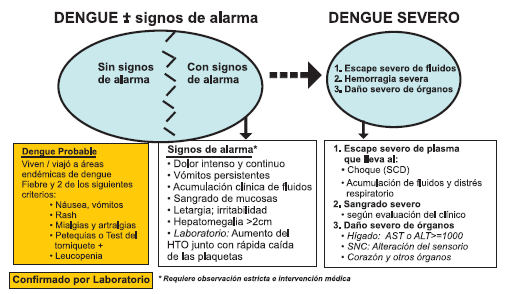 |
| Figura 8. Nueva clasificación del Dengue (OMS). |
Las formas severas están asociadas a una mayor extravasación de plasma, que conlleva al choque y distrés respiratorio; sangrado severo y daño severo de órganos con compromiso hepático, cerebro, corazón, riñón y otros órganos, aunque estos no son tan frecuentes.
Si se esquematiza el curso de la enfermedad del dengue, se puede considerar tres etapas clínicas, a) Etapa febril - que puede ser la única en la mayoría de pacientes; b) Etapa crítica y c) Etapa de recuperación, como se muestra en la figura 9.
La primera etapa febril es de duración variable y está asociada a la circulación del virus en la sangre. En la mayoría de casos la evolución es hacia una mejoría luego de la caída de la fiebre; sin embargo y en otros pacientes la caída de la fiebre puede estar asociada al agravamiento del caso, siendo la defervescencia de la fiebre el heraldo del inicio de la etapa crítica de la enfermedad.
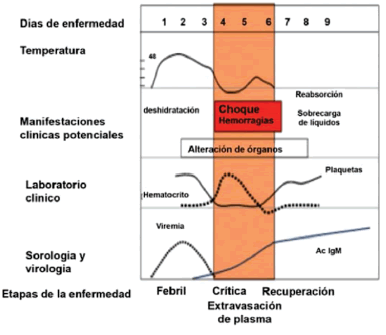 |
| Figura 9. Evolución de la enfermedad en el Dengue. |
En la figura 10 se puede mostrar las manifestaciones clínicas registradas durante la epidemia de dengue en el Hospital de Apoyo de Iquitos.
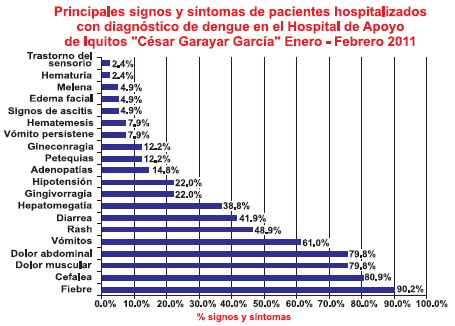 |
| Figura 10 |
Fisiopatología
Para tratar de explicar las formas severas de dengue. Se han planteado diferentes teorías, tales como la secuencial, según la cual una segunda infección debida a un serotipo diferente, produce una amplificación de la infección mediada por anticuerpos con una gran replicación viral y aumento de la viremia, lo que determina la severidad de la infección (17) otros plantean la virulencia de una determinada cepa del virus. Sin embargo hay una explicación más integral que incluye factores epidemiológicos, del huésped y del mismo virus (Figura 11).
El Aedes aegypti introduce el virus del dengue a la piel, siendo la primera célula dendrítica de la epidermis el primer blanco (18) principalmente las células de Langerhans, las que se activan y presentan el virus al linfocito T; mientras los virus que invadieron la sangre son identificados por los monocitos y células endoteliales, que también presentan al virus.
De esta forma los CD4 son los primeros en activarse luego le sigue los CD8, liberando citoquinas.
Usualmente en la infecciones virales la respuesta inmunológica es protectora; sin embargo en el caso de la infección por dengue puede darse una respuesta protectora, pero también una respuesta patológica que se manifiesta por una respuesta con producción excesiva de citoquinas, cambio de la respuesta TH1 a TH2 e inversión del índice CD4/CD8. Este desmesurado incremento de citoquinas aumenta la permeabilidad vascular, conllevando a extravasación del plasma, fenómeno que es esencial conocer para explicar la hipotensión y el choque distributivo que se produce, debido a la salida de agua y proteínas del intravascular al extravascular.
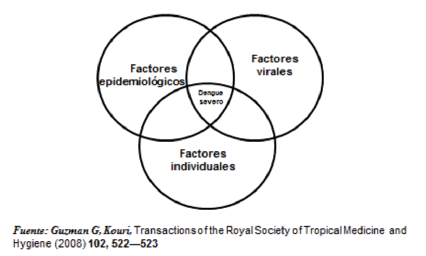 |
| Figura 11. Dengue Severo, Hipótesis Integral, 1997-2007. |
La apoptosis de los linfocitos T es un fenómeno inducido por la infección viral en los primeros días de la infección, lo cual puede limitar o agravar la infección por deterioro de la capacidad inmunológica del paciente. También puede provocar daños en las células endoteliales y de órganos como el hígado, corazón, riñon, cerebro. La plaquetopenia es una manifestación de destrucción de las mismas por fenómeno inmunológico, aunque la intensidad del sangrado no está en relación con los niveles de plaquetopenia (19). Las causas del sangrado son varios incluidos las alteracione vasculares, alteraciones de los mecanismo de la coagulación y fibrinolisis (20).
Diagnostico laboratorial:
La infección por dengue puede ser diagnosticada directamente mostrando la presencia del virus, mediante el cultivo en células ó utilizando técnicas moleculares; o de manera indirecta demostrando la presencia de anticuerpos, utilizando pruebas de ELISA, IHA o neutralización en placas. También están disponibles pruebas rápidas que detectan tanto antígeno viral como anticuerpos.
En el Perú, se cuenta con la técnica de ELISA para la detección de anticuerpos IgM e IgG en suero. La presencia de IgMindica infección aguda y anticuerpos IgG infección pasada.
La detección del virus se hace mediante el cultivo del virus en líneas celulares C6,36, y también mediante la inoculación en cerebro de ratón lactante y su posterior identificación por inmunofluorescencia directa. Otra forma de identificar el RNA viral es utilizando la técnica de RT-PCR y PCR en tiempo real, que no sólo identifica el virus, si no además permite identificar el serotipo y el genotipo. El PCR en tiempo real también permite determinar la carga viral.
Últimamente se cuenta con pruebas rápidas comerciales que detectan el antígeno NS1 y anticuerpos IgM e IgG (21,22). Si bien en trabajos de laboratorio estas pruebas tienen una alta sensibilidad y especificidad, en condiciones de campo la sensibilidad puede no sobrepasar el 60%, por lo que debemos considerar también en el contexto en el que se utilizan.
En la figura 13 se puede mostrar que la pruebas de diagnóstico deben aplicarse según el tiempo de enfermedad, así el aislamiento viral y la detección de RNA por PCR y la detección de antígenos, puede hacerse en los primeros cinco días, y a partir del 5to día en promedio el uso de pruebas para la detección de anticuerpos IgM.
Cuando hay infección secundaria aparece junto a los anticuerpos IgM los anticuerpos IgG y persisten indefinidamente.
 |
Figura 12. Extravación del plasma como consecuencia
del incremento de citoquinas. |
La OMS ha establecido criterios de laboratorio para el diagnóstico como: a) Aislamiento del virus del dengue del suero, el plasma, los leucocitos o las muestras de autopsia. b) Comprobación de un aumento al cuádruplo de los títulos recíprocos de anticuerpos IgG o IgM contra uno o varios
antígenos del virus del dengue en muestras séricas pareadas. C). Demostración del antígeno del virus del dengue en tejidos de autopsia mediante pruebas de inmunoquímica o inmunofluorescencia o en muestras séricas mediante técnicas de inmunoensayo. d) Detección de secuencias genómicas víricas en el tejido de la autopsia, el suero o las muestras de líquido cefalorraquídeo por PCR (16). Para fines prácticos la presencia de anticuerpos IgM anti Dengue, aunado a las manifestaciones clínicas y el contexto epidemiológico, ayudan para el diagnóstico.
 |
| Figura 13. Patrón virológico y serológico en el diagnóstico de dengue. |
 |
| Figura 14. Red Nacional de Laboratorios de Salud Pública, con capacidades para diagnóstico de dengue en el Perú. |
 |
| Figura 15. Centro de Investigación en Enfermedades Tropicales “Maxime Kuczynki, Instituto Nacional de Salud, Iquitos. |
Manejo del Dengue
Para el diagnóstico y manejo de los casos de dengue, es importante hacerse las siguientes preguntas: a) ¿Tiene dengue?; b) ¿Tiene sangrado, comorbilidad o signos de alarma? c) ¿Está en choque?. Según los hallazgos puede darse un tratamiento ambulatorio, hospitalizarlo para observación y tratamiento médico o determinar un tratamiento intensivo.
El manejo del caso dependerá si es un caso sospechoso, con atención ambulatoria, si hay signos de alarma o caso grave que debe ser hospitalizado. Siendo importante tener en cuenta los criterios de alta como: ausencia de Fiebre por 48 horas, mejoría del Cuadro clínico (buen estado general, buen apetito, estado hemodinámico estable, diuresis adecuada, ausencia de distress respiratorio), aumento del recuento de plaquetas, hematocrito estable sin hidratación endovenosa, indagar si tiene familiares o personas mayores en casa.
Si bien no hay tratamiento etiológico contra el dengue, el tratamiento de sostén salva muchas vidas, sobre todo cuando el diagnóstico es oportuno. Siguiendo las recomendaciones de la OMS, el manejo de los casos, según su gravedad pueden ser agrupados en tres grupos, que a continuación describimos:
A.- Los pacientes que pueden tolerar volúmenes adecuados de líquidos por vía oral, mantienen buena diuresis, no tienen signos de alarma, particularmente durante la defervescencia, pueden ser vistos ambulatoriamente o enviados a domicilio, recomendándose la administración de líquidos, agua, sopas, etc, paracetamol para bajar la fiebre y el retorno inmediato al establecimiento si aparecen signos de alarma. Es conveniente tener cartillas con los signos de alarma para entregar a los familiares su estrecha vigilancia.
B.- Pacientes que deben ser hospitalizados para una observación cercana y tratamiento
Se considera en el este grupo a los pacientes que presentan signos de alarma, o tienen condiciones médicas que pueden complicar su manejo, como: gestación, extremos de la vida, obesidad, diabetes mellitus, enfermedades crónicas, tratamiento con anticogulantes o corticoides. También considerar el contexto social de los pacientes, como vivir solo o lejos de un establecimiento de salud. En pacientes que presentan signos de alarma se debe instaurar la reposición de líquidos por vía endovenosa, utilizando cristaloides como ClNa al 0.9%, en dosis de 5-7 mlx Kg x hora. Tomar muestra de sangre para determinar el Hematocrito y hacer el seguimiento cercano, procurando una adecuada perfusión y diuresis. Usualmente se necesita continuar por vía EV al menos 48 horas. En todo momento hay que ver el balance hidroelectrolítico del paciente, y las precauciones para la administración de líquido, considerando que la hipotensión y el choque en el dengue es por extravasación del plasma, siendo distributivo y no por pérdidas al exterior.
C.- Pacientes que requieren tratamiento de emergencia y cuidados intensivos porque tienen dengue severo.
En estos casos debe recurrirse a la adminsitracion por via EV de soluciones cristaloides a 10-20mlxKgxHora en la primera hora, evaluando permanentemente signos vitales, tiempo de llenado capilar, hematocrito, diuresis, para mantener el tratamiento con critaloides y regular según respuesta o recurrir al uso de coloides cuando sea necesaria. Los casos de dengue severo, deben ser atendidos en una Unidad de Cuidados Intensivos, más aún si pueden llegar a complicaciones como hemorragias masivas, coagulación intravascular diseminada, edema pulmonar no cardiogénico, falla multiorgánica, entre otras.
En casos de epidemias es importante la organización de los servicios en todos sus niveles, de modo que la mayoría de casos, que son dengue sin signos de alarma sean vistos en el primer nivel de atención, para que los Hospitales sean reservados en su capacidad para atender los casos severos.
 |
Figura 16. Adaptación de ambientes en el Hospital de
Apoyo de Iquitos, durante el brote de dengue 2011. |
CONTROL DEL DENGUE
Evidentemente el único método para controlar o prevenir la transmisión de los virus del dengue consiste en la lucha contra el Aedes aegypt. Este control de los vectores debe estar basado en la gestión del medio ambiente y los métodos químicos. La eliminación adecuada de los residuos sólidos y la mejora de las prácticas de almacenamiento de agua, entre ellas la cobertura de los envases para evitar que los mosquitos hembra pongan sus huevos, son medidas que deben fomentarse en los programas comunitarios. Para ello es imprescindible la educación, la promoción y la participación comunitaria en la lucha contra el vector, que no solo es una tarea del sector salud.
La presencia o no del dengue básicamente depende de la presencia o no del vector, aun cuando otras variables como la migración estén presentes, por lo que es crítico interrumpir el contacto del vector Aedes aegypt, con los humanos, y esto se da eliminando la posibilidad del desarrollo de sus formas larvarias o adultas fundamentalmente eliminando las opcioes para el desarrollo de las larvas.
Las medidas de control vectorial dependerá del contexto en el que se desarrolla el vector, así en las zonas como Lima, donde no hay lluvias, es importante evitar la proliferación de larvas en recipientes de agua para uso en zonas periféricas, procurando que los tanques bajos y otros recientes estén cubiertos adecuadamente para evitar que los mosquitos hembras ovipositen en ellos, este control incluye el uso de larvicidas como el temephos, debiendo contar con el convencimiento y la aceptación militante de la población. Mientras en áreas lluviosas como son las localidades de la Amazonia, es la eliminación de inservibles que son reservorios del agua de lluvia que se comportan como criaderos, complementado también con el uso de abate en recipientes que son de uso humano, pues también tienen la necesidad de almacenar agua en zonas donde no hay opción de agua por tuberías.
El uso de insecticidas para eliminar mosquitos adultos sólo está justificado cuando se está frente a epidemias, para un control inmediato de la transmisión. Es evidente que si se actúa previamente, eliminando criaderos y al vector en su estadio larvario se evitará la presencia del vector adulto.
Es importante tener en cuenta la vigilancia de la susceptibilidad del vector a los insecticidas, tanto en las formas larvarias, como en las formas adulta, lo cual permite orientar adecuadamente el uso de insecticidas según la ecología local, como es el caso del país donde los nichos ecológicos de la costa y Amazonía, y aún dentro de la misma región, tienen marcadas diferencias.
La gestión integrada para la prevención y control vectorial en el dengue es propugnada por la OMS, que está orientado a desarrollar un proceso racional para el uso óptimo de los recursos que permitan el control vectorial. Este enfoque considera cinco elementos clave en el proceso de gestión, que incluye:
• Promoción, movilización social y legislación, que defina políticas y empodere a las comunidades para la lucha antivectorial.
• Estrechar la colaboración entre el sector de la salud con los otros sectores incluyendo el sector privado, debiendo fortalecer la comunicación entre los responsables políticos, gestores de programas para el control de enfermedades transmitidas por vectores, y otros socios clave.
• Enfoque integrado del control de la enfermedad, que orienten al uso racional de los recursos disponibles, aplicando métodos de control no químico, y químico para el control de vectores integrando creativamente con los otrosmétodos disponibles.
• Toma de decisiones basada en evidencias, adoptando las estrategias de intervención para control vectorial, a la ecología local de los vectores, la epidemiología, resultados de investigaciones operativas y evaluación de la intervenciones.
• Creación de capacidades para el desarrollo de la infraestructura esencial, recursos humanos y financieros a nivel nacional y local para una gestión integral de vectores programas, con base en un análisis de la situación.
Al momento no se cuenta aún con una vacuna eficaz y segura contra el dengue. Hay vacunas de en la que se vienen trabajando, entre las que están la preparadas a partir de: virus vivos atenuados, virus quiméricos vivos atenuados, vacunas inactivadas o de subunidad, y vacunas basadas en el ácido nucleico; sin embargo no tenemos aun un candidato de vacuna que sea eficaz y segura, dado que todas están en desarrollo (23).
Siendo en el dengue un mecanismo inmune primario la neutralización del virus, las vacunas tratan de estimular anticuerpos neutralizantes. Siendo 4 los serotipos de dengue circulantes, la vacuna debe ser tetravalente, por lo cual el primer gran problema ha sido identificar cuatro inmunógenos que den una respuesta inmunológica balanceada que resulte protectora contra estos cuatro virus simultáneamente, además se debe evitar el riesgo teórico de amplificación de anticuerpos que sean inducidos por la vacuna en las personas que lo reciban (24,25). Para la elaboración de la vacuna debiera considerar los ámbitos como Asia y América, que proteja contra los cuatros serotipos del dengue y los genotipos, que pueden variar con el tiempo.
El desarrollo de antivirales contra el virus de hepatitis C y el VIH, albergan la opción de contar con antivirales contra el virus del dengue que permitan la neutralización del mismo (26). El ciclo de vida de este virus muestras pasos, los cuales pueden ser blancos de los antivirales, como en la en la entrada del virus, la fusión de membranas, la replicación del genoma ARN, su ensamblaje y liberación final por la célula infectada.
Actualmente hay varios blancos identificados, entre ellas la proteasa NS3/NS2B y la polimerasa NS5, se está trabajando en E, helicasa NS3 y metiltransferasa NS5 (27). Las características de los antivirales a ser evaluados debieran ser activos contra todos los serotipos, ser efectiva en infecciones de dengue, tanto primarias como secundarias, ser activa por vía oral, ser seguros, estables ante el calor y la humedad, tener una vida útil prolongada y tener costos de producción bajos/razonables, además de ser útiles para adultos y niños. Sabiendo que la viremia ocurre en los primeros días de la infección, y muchos de la pacientes acuden al segundo o tercer dia en enfermedad, será importante, paralelamente, contar con métodos de diagnóstico rápidos que permitan detectar oportunamente la infección, lo cual significa tener estos diagnósticos en el primer nivel de atención. Son retos cuyo desarrollo debe ser teniendo en cuenta un enfrentamiento integral y complementario, para controlar el dengue.
Referencias Bibliográficas
- Organización Panamericana de la Salud.Alerta Epidemiológica: Actualización sobre la situación de Dengue en las
las Américas. 2011, marzo 18. Disponible en:
http://new.paho.org/hq/index.php?option=com_content&task=view&id=4494&Itemid=2481
- Schneider J, Droll D.A time line for dengue in the Americas to december 31, 2000 and noted first occurrences [documento en internet].Washington DC: Pan American Health Organization; 2001. [Fecha de acceso: junio del 2005].
Disponible en: www.paho.org/English/HCP/HCT /VBD/dengue_finaltime.doc.
- Martínez Eric.
Dengue. Estudio Avanzados, 22;2008. Disponible en: http://www.scielo.br/scielo.php?pid=S0103-40142008000300004&script=sci_arttext
- Watts D, Ramírez G, Cabezas C, Wooster MT.Arthropodborne diseases in Peru. In: Ed. Travassos da Rosa AP, Vasconcelos PF, Travassos da Rosa JF. An overview of arbovirology in Brazil and neighboring countries. Belem: Instituto Evandro Chagas; 1998:193-218.
- Phillips I, Need J, Escamilla J, Colan E, Sanchez S, Rodríguez M, et al.First documented outbreak of dengue in the Peruvian Amazon region. Bull Pan Am Health Organ 1992; 26(3): 201-207.
- Finlay C.
El mosquito hipotéticamente considerado como agente transmisor de la fiebre amarilla. An Acad Cien Med La Habana 1881;18:147-169.
- Organización Panamericana de la Salud. Resurgimiento del dengue en las Américas. Bol Epidemiol Of Panam Salud 1997;18(2):4-5.
- Leiva N, Cáceres O. Variabilidad genética de Aedes aegypten algunas áreas del Perú usando Single Stranded Conformational Polymorphism (SSCP). Rev Peru Med Exp Salud Pública 2004;21(3):157-166.
- MINSA.Dirección de Salud V Lima Ciudad. Dirección de Red de Salud Lima Ciudad. Disponible en:http://www.rslc. gob.pe/images/stories/alertas/dengue/2011/Saladengue-09-2011.pdf
- Calisher CH, Karabatsos N, Dalrymple JM, Shope RE, Porterfield JS, Westaway EG, et al.
Antigenic relationships between flaviviruses as determined by cross-neutralization tests with polyclonal antisera J Gen Virol 1989;70(Pt 1):37-43.
- Lewis JA, Chang GJ, Lanciotti RS, Kinney RM, Mayer L, Trent D.Phylogenetic relationships of dengue-2 viruses. Virology 1993;197(1):216-224.
- Rico-Hesse R. Molecular evolution and distribution of dengue viruses type 1 and 2 in nature. Virology 1990;174(2): 479-493.
- Monath TP, Tsai T.
Flavivirus. In: Richman DD, Whitley RJ, Hayden FG (ed.). Clinical Virology. New York: Churchill Livinstone Inc; 1997:1133-1185.
- Mamani E, Álvarez C, Garcia MP; Figueroa D, Gatti M, Guio H, Merino S, Valencia C, Calampa C, Franco L, Cabezas C.
Circulación de un linaje diferente del virus Dengue 2 Genotipo 2 América/Asia en la Región Amazónica del Perú, 2010 Rev Peru Med Exp Salud Pública.
2011; 28(1):72-77.
- Michelli Faria Oliveira MF, Galvão Araújo JM, Ferreira OC Jr., Ferreira DF, Lima DB, Santos FB. Two Lineages of Dengue Virus Type 2, Brazil. Emerg Infect Dis. 2010;16(3):576-578.
- Health Organization.Dengue Guidelines for Diagnosis, Treatment and Control. Geneva:WHO; 2009 Disponible en:
http://whqlibdoc.who.int/publications/2009/9789241547871_eng.pdf.
- Cummings, D.A. et al. Dynamic effects of antibody dependent enhancement on the fitness of viruses. Proc. Natl. Sci. USA, 2005;102(42):15259-15264.
- Wu SJ, Grouard-Vogel G, SunW, Mascola JR, Brachtel E, Putvatana R, Louder MK, Filgueira L, Marovich MA,Wong HK, Blauvelt A, Murphy GS, Robb ML, Innes BL, Birx DL, Hayes CG, Frankel SS.Human skin Langerhans cells are targets of dengue virus infection. Nat Med. 2000;6(7):816-820.
- Schexneider K.I, Reedy, E.A.Thrombocytopenia in dengue fever. Curr. Hemaol Rep. 2005;4:145-148.
- Srichaikul, T, Nimmanntya S.Haematology in dengue and dengue haemorrhagic fever. Baillieres Best Pract. Res Clin. Haematol. 2000;13:261-276.
- Shrivastava A, Dash PK, Tripathi NK, Sahni AK, Gopalan N, Lakshmana Rao PV. Evaluation of a commercial Dengue NS1 enzyme-linked immunosorbent assay for early diagnosis of dengue infection. Indian JMed Microbiol. 2011;29(1):51-55.
- Chaterji S, Allen JC Jr, Chow A, Leo YS, Ooi EE. Evaluation of the NS1 rapid test and the WHO dengue classification schemes for use as bedside diagnosis of acute dengue fever in adults. Am J Trop Med Hyg. 2011;84:224-228.
- Guy B, Almond JW. Towards a dengue vaccine: progress to date and remaining challenges. Comparative Immunology, Microbiology and Infectious Diseases, 2008;2-3:239-252.
- Hombach J.Vaccines against dengue: a review of current candidate vaccines at advanced development stages. Revista Panamericana de Salud Pública, 2007;21:254-260.
- Whitehead SS, et al.Prospects for a dengue virus vaccine. Nature Reviews.Microbiology, 2007;5:518-528.
- Hombach J, et al.Scientific consultation on immunological correlates of protection induced by dengue vaccines report from ameeting held at theWorld Health Organization 17-18 November 2005. Vaccine, 2007;25:4130-4139.
- Johnston PA, et al. HTS identifies novel and specific uncompetitive inhibitors of the two-component NS2B-NS3
1
Instituto Nacional de Salud. 2 Instituto de Medicina Tropical “Daniel A. Carrión” Facultad de Medicina,
Universidad Nacional Mayor de San Marcos (UNMSM). |
