|
Estrógenos
y su rol en la prevención de enfermedad coronaria
Dres. Raúl
Gamboa (*) y Eduardo Matos (**)
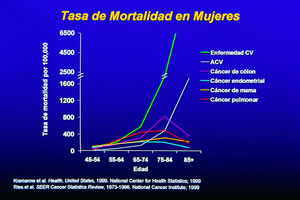
El principal factor
de riesgo de muerte en la mujer posmenopáusica es la enfermedad
cardiovascular (ECV), siendo motivo de 45% de sus fallecimientos, mucho
más que los causados por la suma de todos los tipos de cáncer
(Figura 1) (1). Desde 1984 al presente, más mujeres
que hombres han muerto por ECV, a pesar de que típicamente la enfermedad
cardíaca se desarrolla 10 a 15 años más tarde en
las mujeres (Figura 2)(2-4). El rápido incremento
del riesgo para ECV, después de la menopausia natural y siguiendo
la ooforectomía bilateral, sugieren fuertemente su relación
con el déficit estrogénico (5-7). Diversos factores pueden
explicar el incremento posmenopaúsico de la ECV, incluyendo cambios
adversos en el metabolismo lipídico, en el metabolismo de la glucosa,
así como en factores hemostáticos y en la función
vascular.
En consecuencia, el
reducir el riesgo de ECV adquiere fundamental importancia en el período
posmenopáusico. No obstante, existe cierta incertidumbre sobre
los beneficios y seguridad de la terapia del reemplazo hormonal en base
al resultado de estudios utilizando anticonceptivos orales de primeras
generaciones (estrógenos en dosis altas), en los que se registró
incremento en trombosis venosa, infarto miocárdico y accidentes
cerebrovasculares (8-11). Sin embargo, en múltiples estudios que
emplean nuevos preparados hormonales, en los que las dosis estrogénicas
son menores, a diferencia de los antiguos preparados, las terapias de
reemplazo estrogénico (TRE) y las terapias de reemplazo hormonal
estrógenos y progestágenos (TRH), han demostrado reducir
consistentemente el riesgo de ECV hasta en un
50% (12). Otros tratamientos han sido propuestos como alternativas a TRE/TRH,
incluyendo moduladores selectivos de receptores de estrógenos (MSRE)
(raloxifeno, tamoxifeno), y esteroides con actividad tisular específica
(tibolona) (13-15). Si bien el peso de las evidencias favorecen el efecto
benéfico hormonal en la protección de la ECV, queda aún
en discusión si esta protección es la misma si se trata
de prevención primaria o secundaria de ECV. Otro aspecto de fundamental
importancia y de aclaratoria necesidad, es el referente a la acción
pro-cancerígena de los estrógenos sobre la mama y el útero
(16).
Mecanismos básicos de cardioprotección con estrógenos
| FIGURA
1 |
 |
Actualmente se conoce
dos tipos de receptores estrogénicos, los receptores ER-a y ER-ß;
ambos son miembros de la superfamilia de receptores esteroideos hormonales
(17). Los receptores estrogénicos a y b tienen considerable homología
y, tal como otros receptores hormonales esteroideos, son factores de transcripción
que, cuando son activados, alteran la expresión genética
(18,19). Estos receptores son activados por la unión con los estrógenos,
pudiendo también serlo en ausencia de estrógenos por factores
de crecimiento (20). Este mecanismo puede operar cuando las concentraciones
de factores de crecimiento son altas o cuando las concentraciones de estrógenos
son bajas (hombres o mujeres posmenopáusicas). El descubrimiento
de los ER-ß, en 1996 (17), ha proporcionado nuevas luces en relación
con una posible selectividad tisular de los estrógenos, dado que
la distribución y relativa abundancia de ER-a y ER-b es bastante
diferente. Mientras que algunos tejidos, tales como los ovarios y el útero,
expresan ambos receptores, otros tejidos expresan preferentemente un receptor
más que otro (Tabla 1) (21,22).
Cuando un compuesto estrogénico se une a un receptor, induce en
él cambios en su conformación que permiten que tal receptor
se dimerice. Entonces, el dímero recluta coactivadores y se une
directamente al ADN, a través de elementos de respuesta de estrógenos,
formando así un complejo activo que regula la expresión
genética y la producción de proteínas (23). Además,
puede actuar sobre factores de transcripción, ejemplo NF-kB para
modificar la expresión proteica. El estrógeno o ligando
que se une al receptor determina la función final de este receptor;
esto permite a diferentes estrógenos ser selectivamente activos
en diferentes tipos celulares. Como resultado de estas diferentes vías
de señales, los estrógenos tienen diversos efectos: (a)
modifican las concentraciones plasmáticas de lípidos, (b)
actúan sobre la pared vascular, (c) producen moléculas vasoactivas,
(d) tienen capacidad antioxidante, (e) actúan sobre los sistemas
de coagulación y fibrinólisis, y (f) actúan sobre
el metabolismo de la glucosa. Como consecuencia de estas y otras acciones
es concebible que la terapia estrogénica pueda alterar el curso
y/o prevenir la ateroesclerosis (4).
Los estrógenos
y el metabolismo lipídico
| FIGURA
2 |
 |
La menopausia trae
consigo un cambio en el perfil lipoproteico, con relación al periodo
premenopáusico; así es común encontrar elevaciones
del colesterol total, de las lipoproteínas de densidad muy baja,
tales como las LDL y Lp(a), descenso de las lipoproteínas de densidad
alta (HDL) y una elevación en los niveles de triglicéridos.
Todas estas alteraciones son consideradas factores de riesgo para ECV
(24).
Los efectos de la terapia estrogénica en las concentraciones plasmáticas
lipídicas resultan de la acción estrógeno-receptor
sobre la expresión hepática de genes de apoproteínas
(ApoA, B, D y E, y Lp(a)) (25). La terapia estrogénica incrementa
las lipoproteínas de densidad alta (HDL), lipoproteína antiaterogénica,
y reduce los niveles de las lipoproteínas de densidad baja (LDL)
y de la lipoproteína(a) (Lp(a)), ambas lipoproteínas aterogénicas.
De otro lado, los niveles de
triglicéridos tienden a crecer en los pacientes que reciben estrógenos.
Sin embargo, no se sabe si el incremento de triglicéridos en mujeres
sin hipertrigliceridemia inicial tiene significado clínico (26).
La ruta de administración del estrógeno influye sus efectos
lipídicos. El efecto del estradiol oral (2 mg/día) fue semejante
al uso oral del estrógeno conjugado equino, mientras que la administración
transdérmica del estradiol no tuvo efectos a corto plazo (27).
La falta de beneficios con los estrógenos transdérmicos
posiblemente reflejan la menor exposición hepática al estrógeno,
debido a la ausencia del efecto de primer-paso sobre el hígado.
Sin embargo, tratamientos transdérmicos prolongados (más
de 2 años) lograron reducir el colesterol total y las LDL de manera
dosis dependiente (28).
Los efectos beneficiosos de los estrógenos sobre el perfil lipídico
han sido reconocidos en el VI Reporte del Programa Nacional de Educación
en Colesterol de los Institutos de Salud de los Estados Unidos (29), recomendando
la TRE como primer paso en el manejo de las anormalidades lipídicas
en la mujer posmenopáusica.
| TABLA
1 |
 |
La coadministración
de progestágenos, comúnmente administrados en mujeres con
útero intacto en orden de disminuir la hiperplasia uterina y el
riesgo de cáncer uterino, puede reducir o no afectar los efectos
estrógeno-lipídicos; siendo la magnitud de este efecto dependiente
del progestágeno utilizado (30). Los diversos compuestos hormonales
tienen diferentes efectos sobre los parámetros lipídicos.
En reciente estudio comparativo de TRH y los MSREs (raloxifeno y tamoxifeno),
ambos MSREs fueron comparables con la TRH en la reducción de LDL,
pero ninguno fue tan efectivo como la TRH en incrementar HDL. El raloxifeno
no redujo tan efectivamente los niveles de Lp(a), un factor independiente
de riesgo aterogénico, como lo hicieron el tamoxifeno y la TRH
(Figura 3) (31).
El mecanismo del posible efecto beneficioso de la TRE sobre el riesgo
coronario es probablemente multifactorial y solamente parcialmente mediado
por los cambios en los niveles lipídicos. Se considera que 25 a
50% de la reducción en eventos cardiovasculares es debido a los
efectos sobre los lípidos (12). La observación que en primates
y conejas ooforectomizadas, la combinación de estrógeno
y progesterona no mejoró el perfil lipídico y sin embargo
retardó la ateroesclerosis, es compatible con esa hipótesis
(32,33).
Efectos en la
pared vascular
Los efectos beneficiosos
de los estrógenos en la pared vascular están posiblemente
vinculados a la inhibición de la inflamación, del crecimiento
de las células musculares lisas, y al estímulo de la función
de las células endoteliales.
Los estrógenos, al interferir con la actividad del factor de transcripción
NF-kB, producen una dramática reducción en la expresión
de genes inflamatorios (4). En un modelo de ratones alimentados con dieta
normal o dieta aterogénica, los estrógenos redujeron la
expresión de genes asociados con inflamación de manera dosis
dependiente (4). La capacidad inhibitoria de la actividad del NF-kB varía
de acuerdo con el estímulo estrogénico. El 17b-estradiol
producido por los ovarios es el principal estrógeno circulante,
que, junto con el 17b-etinilestradiol, parecen ser los más potentes
inhibidores de la actividad de NF-kB. El fitoestrógeno ginistein
también inhibe al NF-kB, mientras que los MSREs no tienen efecto
alguno. Diversos estudios ofrecen claras evidencias que los estrógenos
pueden realmente interferir con los eventos tempranos de la inflamación
(4,23).
Numerosos estudios sugieren que los estrógenos influyen la regulación
del tono vascular. Las células endoteliales y musculares lisas
vasculares expresan receptores a y b. Es muy probable que los efectos
de los estrógenos en la musculatura vascular periférica
sean mediados por los ER-b, tipo de receptor predominante en las células
musculares lisas humanas (34), puesto que la experimentación animal
demuestra que los efectos vasculares son los mismos con o sin bloqueo
de ER-a (35). De otro lado, en la vasculatura coronaria, tanto en animales
como en humanos, los estrógenos revierten la vasoconstricción
inducida por acetilcolina, vía estimulación de la sintetasa
del óxido nítrico, a través de la activación
de ER-a(36). El mismo efecto ha sido observado en primates ateroescleróticas
ovariectomizadas (37). Los estrógenos tienen acciones vasodilatadoras
rápidas y efectos a largo plazo que inhiben las respuestas a la
injuria vascular, previniendo la ateroesclerosis. Los efectos rápidos
probablemente ocurren sin cambios en la expresión genética
(efectos no-genómicos), mientras que los efectos a largo plazo
comprenden cambios en la expresión genética (efectos genómicos)
mediada por los receptores. La Tabla 2 muestra los efectos
directos de los estrógenos en los vasos sanguíneos (38).
En cultivos de células endoteliales, tratadas con concentraciones
fisiológicas de estrógenos, se observó una rápida
liberación de óxido nítrico y prostaciclinas sin
alterar la expresión genética. En animales normocolesterolémicos,
el 17b-estradiol incrementa la liberación basal del óxido
nítrico (38). En concentraciones fisiológicas, los estrógenos
actúan a manera de factor hiperpolarizante endotelial, ya que estimulan
la apertura de canales de potasio, hiperpolarizando así la membrana
y produciendo vasorrelajación (39). Concentraciones suprafisiológicas
de 17b-estradiol inhiben las respuestas constrictoras de agonistas directos
de canales de calcio, sugiriendo un efecto calcio antagonista (40). La
prolongada administración estrogénica se asocia a reducción
en las concentraciones plasmáticas de renina, de enzima convertidora
de angiotensina, de endotelina-1 y de expresión del gen vascular
para el receptor de angiotensina-II (AT-1), además de un rápido
incremento de la relación óxido nítrico/endotelina
(41). El efecto final de estos cambios es facilitar la vasodilatación,
inhibir la agregación plaquetaria y reducir los efectos mitogénicos.
El estado estrogénico también parece influir la función
vasomotora endotelial a mayores niveles estrogénicos, mayor respuesta
vasodilatadora flujo dependiente. La respuesta vasomotora endotelial favorable
al tratamiento estrogénico explica los efectos protectores cardiovasculares
de la función ovárica intacta y la del reemplazo estrogénico
en las mujeres posmenopáusicas.
Los estrógenos inhiben directamente la migración y proliferación
de las células musculares lisas in vitro y, en algunos pero no
en todos los estudios, también inhiben la expresión de moléculas
de adhesión por las células vasculares. A largo plazo, los
estrógenos protegen la pared vascular inhibiendo la proliferación
de las células vasculares musculares lisas y acelerando el crecimiento
de las células endoteliales. De otro lado, tanto en animales como
en humanos, la acción protectora inducida por los estrógenos
puede ser inhibida por la utilización simultánea de progestágenos
en dosis altas (42).
Efectos antioxidantes
La oxidación
de las LDL juega un rol muy importante en el desarrollo de la ateroesclerosis.
Los estrógenos reducen la peroxidación lipídica.
El 17b-estradiol es un efectivo antioxidante in vitro y su administración
a mujeres posmenopáusicas disminuye la oxidación de las
LDL (38). Este efecto antioxidante puede deberse a cambios mediados por
la relación estrógeno/receptor en la expresión de
genes para enzimas que regulan la producción local y la degradación
del anión superóxido (43).
Efectos en coagulación
y fibrinólisis
La expresión
hepática de genes para varias proteínas coagulantes y fibrinolíticas
también se regula por estrógenos a través de los
receptores a y b. La terapia estrogénica permanente reduce las
concentraciones del fibrinógeno plasmático, así como
las concentraciones de las proteínas anticoagulantes antitrombina
III y proteína S. Los estrógenos también disminuyen
las concentraciones plasmáticas del inhibidor del activador del
plasminógeno tisular (PAI-1), y altas concentraciones estrogénicas
se asocian con incremento en la fibrinólisis. La terapia estrogénica
también ha sido asociada con concentraciones bajas del factor VII
(38). El efecto de los estrógenos sobre la coagulación depende
en la forma del estrógeno usado, la dosis, y la duración
de la terapia. Hoy se acepta que dosis altas de estrógenos incrementan
las concentraciones de los factores de coagulación y el riesgo
de trombosis. Por el contrario, el uso de TRE en dosis bajas, con o sin
progestágenos, parece afectar ligeramente o en nada los factores
de coagulación (38). El estudio HERS (44), un ensayo prospectivo
y aleatorio del uso de TRH en mujeres posmenopáusicas con enfermedad
coronaria, evaluó el riesgo de tromboembolismo venoso. Este estudio
demostró que después de un seguimiento de cuatro años,
el riesgo relativo se incrementó ligeramente en el grupo tratado
frente al placebo (RR 2,7; p=0,003). El riesgo fue particularmente mayor
en relación con periodos de inmovilización (fracturas, cirugía
u hospitalizaciones no quirúrgicas). De otro lado, el riesgo se
redujo cuando se usó simultáneamente aspirina o estatinas
(RR 0,5) (44). En estudios de observación, no aleatorios, el TRH
se asoció con incremento del riesgo relativo de tromboembolismo
en 2,1 a 3,6 y de embolismo pulmonar en 2,1 (45).
Se puede concluir
que existen evidencias de pequeño, pero significativo, incremento
del riesgo de tromboembolismo con TRH. En el caso de mujeres posmenopáusicas
saludables, el riesgo absoluto es extremadamente bajo, y en el caso de
mujeres con conocidos factores de riesgo -tales como inmovilización,
cáncer o fractura de miembros inferiores-, el riesgo se incrementa.
Estrógenos
y la sensibilidad a la insulina
Ha sido demostrado
que tanto la glicemia basal como los niveles de insulina en ayuno, y la
respuesta insulínica a la ingesta de glucosa, disminuyeron en mujeres
posmenopáusicas después de un año de tratamiento
con TRE (38,41). El mismo resultado fue observado en mujeres posmenopáusicas
diabéticas, dependientes de insulina (38). La experimentación
en animales sugiere que la deficiencia estrogénica reduce el transporte
de glucosa mediado por la insulina (41).
Estrógenos
y ateroesclerosis
Los efectos previamente
descritos sobre el metabolismo lipídico, pared vascular, acción
sobre radicales libres, coagulación y fibrinólisis y metabolismo
glúcido, todos ellos tienen efectos antiateroescleróticos.
Existen abundantes
evidencias en estudios prospectivos y retrospectivos que demuestran que
la TRE (estrógenos) reduce el riesgo primario de enfermedad cardiovascular
en 35 a 50 por ciento de mujeres posmenopáusicas (4-7). Menor es
la información disponible sobre el efecto de la TRH (estrógenos
y progestágenos), pero un reciente estudio demostró definidos
efectos beneficiosos (46). Algunas observaciones sobre prevención
secundaria, también demuestran el efecto protector cardiovascular
de la terapia TRE (47,48). Así también, los resultados a
largo plazo de mujeres posmenopáusicas que han sido sometidas a
angioplastia coronaria fueron mejores entre aquellas bajo tratamiento
estrogénico (Figura 4) (49). Sin embargo, el
estudio del Corazón y TRH (44), el primer estudio aleatorio para
examinar los efectos de la terapia con estrógenos equinos conjugados
más medroxiprogesterona en 2,700 mujeres posmenopáusicas
con enfermedad coronaria, en tratamiento promedio de 4 años demostró
un incremento en los eventos coronarios durante el primer año y
una reducción en los años cuarto y quinto, pero con incremento
en los accidentes tromboembólicos y en la enfermedad vesicular
(44). Estos hallazgos podrían ser debidos a los efectos de los
estrógenos conjugados equinos y/o de la medroxiprogesterona en
tejidos no vasculares, tales como los efectos hepáticos, que pueden
alterar el perfil de coagulación e incrementar los eventos trombóticos.
Los autores concluyen que no es recomendable iniciar el tratamiento con
TRH con el objeto de prevenir secundariamente la enfermedad coronaria.
Sin embargo, podría ser adecuado continuarlo en las pacientes que
ya estaban en tratamiento. Este controversial estudio sobre TRH en la
mujer posmenopáusica con ECV, abre interrogantes que posiblemente
sean aclarados cuando se conozcan los resultados del Estudio WELL-HART,
ensayo de prevención secundaria con puntos finales angiográficos,
para el año 2,001(16), o el WHI (Women's Health Initiative) que
evaluará TRE versus TRH en prevención primaria, para el
año 2,005 (50). Hasta el momento, el peso de las evidencias señala
una evidente ventaja de la mujer posmenopáusica en TRE/TRH en programas
de prevención primaria. La bondad de este tratamiento en relación
con la prevención secundaria está a la espera de resultados
de nuevos estudios aleatorios.
Conclusiones
La enfermedad cardiovascular
es un importante y creciente factor de riesgo en las mujeres posmenopáusicas.
El resultado de las actuales investigaciones sugiere que la terapia de
reemplazo hormonal, tanto si se realiza con estrógenos solos como
si se asocia con gestágenos, es cardioprotectora. El descubrimiento
que los estrógenos tienen efectos a corto y a la largo plazo sobre
la pared vascular, así como sobre otros factores participantes
en el proceso ateroesclerótico, independientes de la circulación
reproductiva, hacen de ellos importantes copartícipes en el arsenal
de terapias cardiovasculares para la prevención y tratamiento de
la ateroesclerosis. Podemos concluir que tratándose de prevención
primaria de ECV debemos: a) iniciar la terapia hormonal basados en un
adecuado análisis de los beneficios y riesgos potenciales, b) de
acuerdo a datos de observación se favorecerá al 50 por ciento
de las mujeres tratadas. En el caso de prevención secundaria de
ECV: a) no se debe iniciar terapia hormonal sólo con el propósito
de prevenir eventos cardíacos adicionales, b) basados en años
de seguimiento y de acuerdo con los resultados favorables observados en
mujeres con ECV que ya se encuentran en tratamiento, ellas deben continuar
en terapia hormonal, y c) el tratamiento debe incluir otras intervenciones,
tales como bloqueadores adrenérgicos, aspirina, estatinas u otras.
en mujeres con ECV que ya se encuentran en tratamiento, ellas deben continuar
en terapia hormonal, y c) el tratamiento debe incluir otras intervenciones,
tales como bloqueadores adrenérgicos, aspirina, estatinas u otras.
Bibliografía
1. Eaker, E; Chesebro,
JH; Sacks, FM; Wenger, NK; Whisnant, JP. and Winston, M. Cardiovascular
disease in women. Circulation 1993; 88:1999-09.
2. Kramarow, E. Health. United States 1999, National Center of
Health Statistics: 1999.
3. Ries, F. and Seer, F. Cancer Statistics Review. 1973-1996. National
Cancer Institute; 1999.
4. Harnish, D. Symposium on Hormone Replacement Therapy in the
Cardiovascular System. May 2000, Victoria.British Columbia.
5. Barret-Connor, E. Bus TL. Estrogen and Coronary Heart Disease
in Women. JAMA 1991;265:1861-64.
6. Colditz, GA. Menopause and the risk of coronary Heart disease
in women. N Engl J Med 1987; 316:1105-10.
7. Sullivan, JM. Estrogen replacement and coronary artery disease.
Effect on survival in postmenopausal women. Arch Intern Med 1990;150:
2557-62.
8. Tooke, JE; Mc Nicol, GP. Thrombotic disorders associated with
pregnancy and the pill. Clin Haematol 1981; 10: 613-30.
9. Kaplan, NM. Cardiovascular complications of oral contraceptives.
Ann Rev Med 1978;29:31-40.
10. Stubblefield, PG. Cardiovascular effects of oral contraceptives:
a review. Int J Fertil 1989; 34(Suppl): 40-9.
11. Vessey, MP. and Mann, JL. Female sex hormones and thrombosis:
epidemiological aspects. Br Med Bull 1978; 34: 157-62.
12. Stampfer, MJ; Colditz, GA. and Willet, WC. Postmenopausal estrogen
therapy and cardiovascular disease: ten year follow-up from Nurses' Health
Study. New Eng J . Med 1991; 325: 756-62.
13. Alsh, BW; Kuller, LH. and Wild, RA. Effects of raloxifene on
serum lipids and coagulation factors in healthy postmenopausal women JAMA
1998; 279:1445-51.
14. Cattaneo, M; Baglietto, L. and Zighetti, ML. Tamoxifen reduces
plasma homocysteine levels in healthy women. Br J Cancer 1998; 77: 2264-67.
15. Thiewaund, JM. Prevención de la pérdida ósea
y síntomas post-menopáusicos: Estrógenos equinos
conjugados más acetato de medroxiprogesterona versus tibolona.
Ec Ginecol Obstetrics 1999; 6: 285-89.
16. Cúneo, CA. Terapia de reemplazo hormonal en prevención
cardiovascular. ¿Y ahora que?. Rev Fed Arg Cardiol 1999; 28: 133-9.
17. Walter, P; Green, S. and Green, G. Cloning of the human estrogen
receptor cDNA. Proc Natl Acad Sci USA 1985; 82:7889-93.
18. Shibata, H; Spencer, TE. and Onate, SA. Role of co-activators
and co-repressors in the mechanism of steroid/thyroid receptor acting.
Recent Prog Horm Res 1997; 52: 142-65.
19. Brown, M. Estrogen receptor molecular biology. Hematol Oncol
Clin North Am 1994; 8: 101-12.
20. Power, RF; Mani, SK; Codina, J; Conneely, OM; O'Malley, BW.
Dopaminergic and ligand-independent activation of steroid hormone receptors.
Science 1999; 254:1639-45.
21. Karas, RH; Patterson, BL. and Mendelsohn, ME. Human vascular
smooth muscle cells contain functional estrogen receptor. Circulation
1994; 89:1943-80.
22. Losordo, DW; Kearney, M; Kim, EA; Jekanowski, J. and Isner, JM.
Variable expression of the estrogen receptor in normal and atherosclerotic
coronary arteries of premenopausal women. Circulation 1994; 89:1501-10.
23. Cowley, SM; Hoare, S; Musselman, S. and Parker, MG. Estrogen
receptors a y b form heterodimers on DNA. J Biol Chem 1997; 272:19858-64.
24. Stevenson, JC; Crook, D. and Golddland, IF. Influence of age
and menopause on serum lipids and lipoprotein in healthy women. Atherosclerosis
1993; 98: 83-90.
25. Mendelsohn, ME. and Karas, RH. Estrogen and the blood vessel
wall. Curr Opin Cardiol 1994; 9: 619-26.
26. The Writing Group for the PEPI Trial. Effects of estrogen or
estrogen/progestin regimens on heart disease risk factors in postmenopausal
women: The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial.
JAMA 1995; 274:1676-84.
27. Walsh, BW; Schiff, I. and Rosner, BE. Effects of postmenopausal
estrogen replacement on the concentrations and metabolism of plasma lipoproteins.
N Engl J Med 1991; 325:1196-05.
28. Ory, SJ; Field, CS. and Herrman, RR. Effects of long-term transdermal
administration of estradiol on serum lipids. Mayo Clin Proc 1998; 73:
735-40.
29. Sixth Report of the Joint National Committee on Prevention, Detection,
Evaluation, and Treatment of High Blood Pressure (JNC VI). Arch Intern
Med 1997;157: 2413-46.
30. Ottosson, VB; Johansson, BG. and von Schoultz, B. Subfractions
of high-density lipoprotein cholesterol during estrogen replacement therapy:
A comparison between progestogen and natural progesterone. Am J Obstet
Gynecol 1985; 51: 746-52.
31. Barret-Connor, E. and Wingard, DL. Postmenopausal estrogen
use and heart disease risk factors. Trends Endocrinol Metab 1999;10: 320-5.
32. Wagner, JD; Clarkson, TB. and St Clair, RW. Estrogen and progesterone
replacement therapy reduces low density lipoprotein accumulation in the
coronary arteries of surgically postmenopausal cynomolgus monkeys. J Clin
Invest 1991; 88:1995-00.
33. Haarbo, J; Let-Espensen, P; Stender, S. and Christiansen, C. Estrogen
monotherapy and combined estrogen-progestogen replacement therapy attenuate
aortic accumulation of cholesterol in ovariectomized cholesterol-fed rabbits.
J.Clin Invest 1991; 87:1274-8134.
34. Iafrati, MD; Karas, RH. and Aronovitz, M. Estrogen inhibits
the vascular injury response in estrogen receptor a-deficient mice. Nat
Med 1997; 3: 545-8.
35. Lindner, V; Kim, SK; Karas, RH; Kuiper, GGJM; Gustavsson, J; and
Mendelsohn ME. Increased expression of estrogen receptor b mRNA in
male blood vessels after vascular injury. Circ Res 1998;83:224-9.
36. Chen, Z; Yuhanna, IS; Galchera-Gargora, ZI; Karas, RH; Mendelsohn,
ME. and Shjaul, AW. Estrogen receptor alpha mediates the nongenomic
activation of endothelial nitric oxide synthase by estrogen. J Clin Invest
1999;103:401-6.
37. Williams, JK; Adams, MR; Herrington, DM. and Clarkson, TB.
Short-term administration of estrogen and vascular responses of atherosclerotic
coronary arteries. J Am Coll Cardiol 1992; 20: 452-7.
38. Mendelsohn, ME. and Karas, RH. The protective effects of estrogen
on the cardiovascular system. N Engl J Med 1999; 340:1801-11.
39. Wellman, GC; Bonev, AD; Nelson, MT. and Brayden, JE. Gender
differences in coronary artery diameter involve estrogen, nitric oxide
and calcium dependent potassium channels. Circ Res 1996; 79:1024-30.
40. Freay, AD; Curtis, SW; Korach, KS. and Rubanyi, GM. Mechanism
of vascular smooth muscle relaxation by estrogen in depolarized rat and
mouse aorta: role of nuclear receptor and calcium uptake. Circ Res 1997;
81: 242-8.
41. Samaan, SA. and Crawford, MH. Estrogen and cardiovascular function
after menopause. JACC 1995; 26:1403-10.
42. Hanke, H; Hanke, S. and Bruck, B. Inhibition of the protective
effect of estrogen by progesterone in experimental atherosclerosis. Atherosclerosis
1996; 121:129-38.
43. Arnal, JF; Clamens, S. and Pechet, C. Ethinylestradiol does
not enhance the expression of nitric oxide synthase in bovine endothelial
cells but increases the release of bioactive nitric oxide by inhibiting
superoxide anion production. Proc Natl Acad Sci USA,1996; 93: 4108-13.
44. Hulley, S; Grady, D. and Bushi, T. For the Heart and Estrogen/progestin
Replacement Study (HERS) Research Group. Randomized trial of estrogen
plus progestin for 45. secondary prevention of coronary heart disease
in postmenopausal women. JAMA 1998; 280: 605-12.
46. Gutthan, SP; Rodríguez, LAC. and Castellsague, J. Hormone
replacement therapy and risk of venous thromboembolism: Population based
case-control study. BMJ 1997; 314: 796-04.
47. Van Baal, WM; Kooistra, T. and Stehouwer, CD. Cardiovascular
disease risk and hormone replacement therapy (HRT): a review based on
randomized, controlled studies in postmenopausal women. Curr Med Chem
2000; 7: 499-17.
48. Grodstein, F; Stampfer, MJ. and Colditz, GA. Postmenopausal
hormone therapy and mortality. N Engl J Med 1997;336:1769-75.
49. Grodstein, F; Stampfer, MJ. and Manson, JE. Postmenopausal
estrogen and progestin use and the risk of cardiovascular disease. N Engl
J Med 1996; 335:1406-13.
50. O'Keefe, JH; Kim, SC. and May, RR. Estrogen replacement therapy
after coronary angioplasty in postmenopausal women. J Am Coll Cardiol
1997; 29:1.
51. Petitti, DB. Hormone replacement therapy and heart disease
prevention. Experimentation Trumps Observation (Editorial). JAMA 1998;
280: 650-52.
(*) Profesor Principal
de Fisiología y Medicina, Universidad Peruana Cayetano Heredia.
(**) Cardiólogo Hospital Militar Central.
|
