Manejo de las infecciones oportunistas en el SIDA
Eduardo Ticona Chávez
Generalidades
Las Infecciones Oportunistas (IOs) son producidas por microorganismos llamados agentes oportunistas, que a diferencia de los pátogenos, necesitan que el huésped esté inmunosuprimido para que ocasionen enfermedad. En el caso de las personas que viven con la infección VIH-SIDA (PVVS) las IOs se producen cuando el nivel de linfocitos CD4 es menor de 200 cls/µL, lo que define al Síndrome de Inmunodeficiencia Adquirida (SIDA). Estas IOs, pueden surgir a partir de la activación de infecciones latentes, como a partir de exposiciones recientes (1,2), por lo tanto son influenciadas tanto por el grado de inmunosupresión como por la exposición al medio ambiente. El mayor grado de inmunosupresion favorece diferentes IOs, como si existieran inmunodeficiencias específicas para cada agente (Figura 1) (3).
| figura 1 |
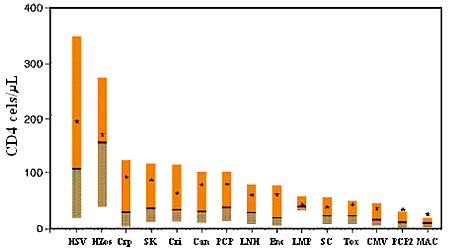 |
| Figura 1. Rango de Linfocitos CD4 en el momento del diagnóstico de enfermedad oportunista en el PVVS |
Las IOs son las que llevan a la muerte a las personas con SIDA, sin embargo su adecuado manejo ha demostrado una mejora en la calidad y la sobrevida de los PVVS. Este mejor manejo se basa en el reconocimiento oportuno de la infección oportunista, así como su adecuado tratamiento (4, 5).
La terapia antirretroviral de gran actividad (TARGA) es el arma más efectiva para prevenir las IOs, por lo que debe ser indicada a las PVVS que califican para dicha terapia (6). Sin embargo, la profilaxis contra las IOs continúa siendo útil durante los primeros meses mientras se administra la TARGA, así como los que no pueden recibirla o fracasan a ésta. Cuando se evidencia la restauración del sistema inmune por la TARGA se puede detener la profilaxia, lo que permite simplificar el tratamiento, reducir la toxicidad e interacción de drogas, disminuir el costo de los cuidados médicos, y potencialmente facilitar la adherencia a los regimenes antiretrovirales. Sí los linfocitos CD4 disminuyen nuevamente a niveles de riesgo, se recomienda reiniciar la profilaxis.
Epidemiologia de las IOs en el Perú
Las IOs asociadas a SIDA más frecuentes en nuestro país son tuberculosis, candidiasis esofágica, diarrea crónica, criptococosis, toxoplasmosis, pneumocistosis (Figura 2). La eficacia de la profilaxia contra el PCP ha incidido en la franca disminución de su incidencia. En nuestro medio, no todos los pacientes tienen acceso a los exámenes que permitan el diagnóstico de las diversas IOs, por lo que debemos disponer de enfoques de manejo que consideren estas limitaciones y permitan resolver problemas (7).
| figura 2 |
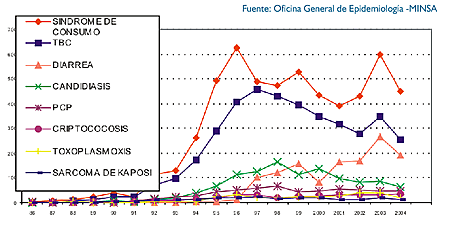 |
| Figura 2. Enfermedades oportunistas frecuentes en el momento de reporte de caso de SIDA Perú periodo 1986-2004. |
Manejo específico de las IOs más
frecuentes en la Práctica Clínica
Se aconseja tener presente las consideraciones descritas en la Tabla 1 en la atención de toda PVVS frente a las infecciones oportunistas.
| TABLA 1 |
CONSIDERACIONES PARA EL RECONOCIMIENTO
Y MANEJO DE LAS INFECCIONES OPORTUNISTAS |
|
- La persona con IOs, puede no tener conocimiento previo de su infección por el VIH.
- Las IOs pueden expresarse principalmente en un organo, pero generalmente son sistémicas.
- Pueden coexistir más de una IO en un mismo paciente.
- Puede haber más de una IO en un mismo órgano.
- El paciente puede acudir por síntomas de una IO, pero el reconocimiento y el manejo de otra IO puede ser más importante.
- Existen afecciones metabolicas asociadas al SIDA, que pueden confundir la evolución de las IOs.
- No solo las IOs afectan a los pacientes con SIDA, sino también otras enfermedades infecciosas u otras afecciones pueden afectarlos.
- El estar bajo profilaxis, disminuye el riesgo de la infección oportunista pero no la anula.
- Cuando se desarrolla una IO bajo profilaxis para dicha infección hay que pensar en resistencia a dicho farmado aintiinfeccioso.
- La escasa o nula respuesta al tratamiento de una IO, debe plantear: el descarte de otra IO, de una respuesta paradojal o de resistencia a dicho farmado antiinfeccioso.
- La sepsis es la más frecuente causa de muerte de un paciente con SIDA. La que puede surgir dentro de un adecuado manejo de una IO.
|
|
Debido a la falta de información del riesgo de infección por el VIH en la población general, éstas pueden estar infectadas y no saberlo, por lo que muchas veces el diagnóstico de una IO, se hace primero que el diagnóstico de la condición de VIH/SIDA. Es en ese contexto que debemos estar preparados para reconocerlas en cualquier momento.
Se debe tener presente que si bien un paciente acude con síntomas dominantes de cierta IO, es probable que podamos descubir en la evaluación clínica otras IOs activas o que están evolucionando aunque con expresión clínica menor. Por ello es necesario una evaluación clínica completa, sea cual fuera la molestia que motiva la consulta. Además un paciente en TARGA puede desarrollar una infección oportunista, en la primeras semanas de TARGA por incubación silente; o posteriormente por falta de adherencia, pobre absorción de los medicamentos, desfavorable interacción farmacocinética o desarrollo de resistencia del virus.
Tuberculosis (TB) Pulmonar y Extrapulmonar
Premisas importantes
El M. tuberculosis (BK) incrementa la replicación viral del VIH, por lo que acelera la progresión al SIDA y/o a la muerte. El retraso en el diagnóstico o en el inicio de tratamiento es extremadamente grave para el paciente (8).
La TB-MDR es prevalente en la personas con co-infección VIH/TB (9,10) por lo que en todos los casos se debe solicitar cultivo y sensibilidad antimicrobiana para corregir la terapia de ser necesario durante el seguimiento.
Diagnóstico y tratamiento de TB Pulmonar
La TB pulmonar es la forma clínica más frecuente, los síntomas son indistinguibles del paciente que no tiene VIH, el paciente acude con tos y expectoración (pudiera no ser productiva) por más de 2 semanas, fiebre o febrícula y sudoración de presentación vespertina, astenia, anorexia y pérdida de peso; la hemoptisis es rara (11). Al examen se evidencia el mal estado del paciente y los hallazgos auscultatorios pueden revelar crepitantes basales o ser normales. La radiografía de torax (RX) es normal en el 5% de los casos, demostrando mayormente engrosamiento hiliar e infiltrado alveolar uni o bibasal, a diferencia del infiltrado apical o cavitación caracteristica de TB en inmunocompetentes (11).
Se debe solicitar dos baciloscopias en esputo como mínimo, las que son positivas en menos del 50% de los casos (la ausencia de cavernas impide el desarrollo de población de M. tuberculosis de crecimiento rápido), por ello a toda PVVS sospechosa de TB se le debe solicitar cultivo para micobacterias en todas sus muestras baciloscópicas.
Si la baciloscopía es negativa y se continúa sospechando en tuberculosis, deberá iniciar el tratamiento TB el cual debe ser indicado por nueve meses (2HRZE/7H2R2) si se dispone de posibilidades se debera solicitar el Test de látex para antígeno criptocococico en suero, así como frotis y cultivo de médula osea para descartar histoplasmosis. De no apreciarse mejoría clínica, o existir una recrudescencia luego de una corta mejoría podriamos estar frente a: I) TB-MDR, II) Síndrome de reconstitución inmune, III) se trata de otra infección, ó IV) existe una infección asociada además de la TB. Requiriendo en todos los casos manejo especializado.
Diagnóstico y tratamiento de TB extrapulmonar
Las formas extrapulmonares aunque menos frecuentes que la pulmonar, son más frecuentes en la PVVS (20% vs 10%), generalmente revelan una enfermedad diseminada, la cual ocurre preferentemente cuando existe un CD4 < de 100 cels/µL.
El paciente puede no tener síntomas respiratorios pero la fiebre, astenia, anorexia y pérdida de peso son frecuentes, el paciente presenta síndromes clínicos dependientes de los órganos afectados, tales como síndrome meningeo, pleural, ganglionar, peritoneal, diarréico crónico, o simplemente un Síndrome febril persistente y/o consuntivo sin causa definida (12-13). El diagnóstico puede hacerse por la demostración del BK en dichos organos o por descarte de otras afecciones oportunistas. El diagnóstico diferencial debe considerar a histoplasmosis, criptococosis o citomegalovirus. Luego de haber cultivado para BK varias muestras de esputo, heces, orina u otras, se debe iniciar tratamiento TB. En estos casos la búsqueda de BK a través de la cuerda encapsulada parece ser promisorio (14).
Profilaxis y cuidados
Toda persona diagnosticada de Infección VIH, debe ser evaluada con una RX y dos baciloscopías en esputo a fin de descartar enfermedad tuberculosa; de encontrarse una RX anormal se recomienda realizar broncoscopía. Si posee sintomas que sugieran enfermedad deberá procederse como lo indicado anteriormente. De no encontrarse evidencia de enfermedad TB, se indicará profilaxis con INH 300mg/día por 1 año (aunque pudiera extedenderse a mas de un año si no se inicia TARGA dentro de este periodo), se debe asociar piridoxina 50/mg/kg por el riesgo de desarrollar neuropatía periferica. Si ha tenido TB anteriormente y ha recibido tratamiento, debe recibir profilaxis si se encuentra en contacto con personas con TB activa (15,16). La administración de la vacuna BCG a las PVVS está contraindicada, por el riesgo de ocasionar enfermedad diseminada.
Interacción con TARGA
La Rifampicina no debiera ser co-administrada con: amprenavir, indinavir, lopinavir/ritonavir, nelfinavir, saquinavir, o delavirdine (16). Sin embargo, ésta puede ser usada con ritonavir, ritonavir más saquinavir, efavirenz, y posiblemente con nevirapine. La Rifabutina es una aceptable alternativa de rifampicina pero su escasa disponibilidad no la hace recomendable.
Candidiasis Oral y Esofágica
Diagnóstico y tratamiento
de la candidiasis orofaringea
El paciente acude refiriendo ardor en la boca o faringe, pérdida del sabor a los alimentos, al examen de la cavidad oral se aprecia áreas eritematosas de bordes imprecisos (candidiasis oral atrofica) o presencia de placas blanquecinas o muget (candidiasis pseudomembranosa), o erosiones en las comisuras labiales (queilitis angular). El diagnóstico se hace a través de la demostración de levaduras con hifas o pseudohifas en un extendido en fresco utilizando KOH. Sin embargo a pesar de lo fácil de este examen, no siempre esta disponible, por lo que el diagnóstico es básicamente clínico. El muget podemos confirmarlo utilizando un bajalengua que nos permita desprender dichas placas (la leucoplasia vellosa no permite este procedimiento). El tratamiento es con Nistatina en tabletas de 500,000 ui, la cual debera disolverse en la cavidad oral (su acción es por contacto). Se administra luego de los alimentos y antes de dormir. Cuando no hay mejoria clínica, debido a resistencia natural o adquirida se podrá utilizar, fluconazol 150 mg/día por 7 días o anfoterecina B.
Diagnóstico y tratamiento
de la candidiasis esofágica
El paciente acude refiriendo disfagia, odinofagia y/o dolor retroesternal. Al examen se puede o no apreciar candidiasis orofaringea. El diagnóstico se realiza por muestra histopatológica compatible obtenida por biopsia a traves de endoscopía. El tratamiento es con Fluconazol 400 mg c/12 hs durante 10 días o Anfoterecina B 0,7 mg/kg diario por 7 a 10 días.
Profilaxis
Si las recurrencias son frecuentes o severas se pudiera considerar la administración de fluconazol oral 100-200 mg diario como profilaxis secundaria, sin embargo el potencial desarrollo de resistencia a los azoles debe tomarse en cuenta en tratamiento de largo tiempo (17).
Diarrea Crónica
Diagnóstico y tratamiento
La enfermedad diarréica es muy frecuente en las personas con SIDA (18). Los agentes infecciosos son diversos, siendo los parásitos los más prevalentes. Los episodios diarréicos agudos que podrían autolimitarse en pocos días, en estas personas se hacen crónicos o recurrentes, asociándose por ello un síndrome consuntivo progresivo. Generalmente el paciente acude con deposiciones acuosas o pastosas de 15 días o varias semanas de evolución. Si la diarrea es severa, contiene sangre, se asocia a fiebre con escalofrios, o desarrolla deshidratación, amerita evaluación especializada.
Se debe solicitar un examen de parásitos en heces y coprocultivo a fin de orientar la terapeútica. De cualquier manera se recomienda iniciar con Trimetoprim-Sulfametoxazol (TMP-SMX) en dosis para tratar Isospora belli (20mg de TMP/kg/día) por tres semanas, que nos permite cubrir además cyclosporiasis, sobrepoblación bacteriana o diversas entero-bacterias. De no haber mejoria en el número o volumen de las cámaras diarréicas al tercer día, se sugiere cambiar a Ciprofloxacina 500mg BID por 10 días, lo que cubriría Campylobacter, o enterobacterias resistentes al TMP-SMX. De no haber mejoría luego del tercer día se recomienda asociar Metronizadol por 10 días con lo que estamos cubriendo Clostridium difficile, amebiasis, giardiasis. De no haber aún mejoría se deberan explorar en laboratorios especializados la presencia de Cryptosporidium, Microsporidium, M. tuberculosis, con coloraciones especiales. De no encontrarse ninguno de estos, es mandatario una endoscopía digestiva alta y baja a fin tomar muestras histológicas que permitan descartar diversos agentes dentro de ellos, citomegalovirus, histoplasmosis o neoplasias intestinales. De encontrarse algunos de estos agentes se deberá indicar el tratamiento correspondiente.
La Crytosporidiosis es de muy difícil manejo debido a la ausencia de tratamiento específico, la paramomicina es transitoriamente eficaz y últimamente la nitazoxanida 1g BID por 2 semanas muestra mayor utilidad (19). La microsporidiosis puede ser tratada con albendazol 400mg BID por al menos 3 semanas (20). En general el riesgo de recurrencia de estos agentes es muy alto, siendo la TARGA el tratamiento definitivo al reconstituir el sistema inmune (21).
Los agentes antiperistálticos (ej; loperamida) pueden ser usados, sin embargo no deben ser indicados en pacientes quienes tienen fiebre alta o presentan sangre en las heces.
Dentro de un curso crónico de diarrea, puede instalarse un episodio agudo de diarrea, que puede llevar a deshidratación severa, que por la cronicidad del evento, el clínico puede descuidar la reposición hidrica agresiva, llegando el paciente a insuficiencia renal aguda.
Profilaxis
La profilaxis indicada contra PCP (ver profilaxis PCP), permite cubrir agentes de diarrea tales como isosporiasis y cyclosporiasis. La profilaxis se debe descontinuar si el paciente en TARGA ha incrementado sus linfocitos CD4 > 200 cels/µL por al menos 3 meses. La profilaxis debiera ser reintroducida si los linfocitos CD4 disminuyen a <100-200 cels/µL. A causa del potencial riesgo de transmisión por fomites, se recomienda que las PVVS (especialmente las severamente inmunocomprometidas), no debieran compartir el mismo cuarto con un paciente con cryptosporidiosis y microsporidiosis. El personal de salud debe tener mucho cuidado en el lavado de manos en la atención de estos pacientes.
Meningitis Criptococósica
Diagnóstico y tratamiento El paciente acude refiriendo cefalea persistente de intensidad creciente >– 2 semanas de evolución, pudiendo asociarse náuseas, vómitos, inestabilidad para la marcha y diplopia. Al examen el paciente se queja de cefalea severa y el examen de fondo de ojo puede demostrar edema de papila. Los signos de irritación meningea son discretos y los signos neurológicos focales son raros.
El incremento de la presión de apertura (PA) en la punción lumbar, orienta el diagnóstico pero mejor aún sugiere el pronóstico. El diagnóstico se realiza a través de la presencia de levaduras capsuladas en el examen de tinta china en el 80% de los casos, el resto son positivos en el cultivo en el medio de Sabouraud. El test de látex para antigeno criptocococico es diagnóstico definitivo, pero la disponibilidad es limitada por su costo. Las alteraciones citoquímicas del LCR son discretas, siempre deberá solicitarse el test de ADA y cultivo para M. tuberculosis a fin de descartar TB meningea. El tratamiento se basa en dos aspectos importantes: La terapia antimicótica y el manejo de la hipertensión endocraneana (HEC). El anfoterecina B es el medicamento de elección en la fase de inducción con dosis de 0,7 a 1 mg/kg/día por 15 días, y continuando la fase de consolidación con fluconazol 800mg por 2 días y luego 400mg por 8 a 10 semanas. La evacuación del LCR a traves de punciones lumbares una a dos veces al día hasta que la PA sea menor de 200mm de agua, permitirá disminuir el riesgo de muerte que se produce en los primeros días de iniciada la terapia antimicótica. Sólo en presencia de signos de encefalitis se recomienda el uso de corticoides. La eficacia del Manitol u otros medicamentos para el manejo de la HEC en Meningitis criptocococica no está demostrada.
Profilaxis y cuidados
La profilaxis primaria es controversial (22). Como profilaxis secundaria, es necesario el uso de fluconazol 200mg diarios, para prevenir las recurrencias (23,24). La profilaxis secundaria puede ser descontinuada en pacientes con sostenible incremento en CD4 >100-200cels/µL por más de 6 meses en respuesta a TARGA (25,26), como práctica realizamos una PL a fin de determinar la negatividad del cultivo en el LCR, aun cuando el paciente es asintomático. La Profilaxis deberá reiniciarse si el recuento de linfocitos CD4+ disminuye a <100-200 cels/µL.
Encefalitis por Toxoplasma
Diagnóstico y tratamiento
Persona que acude con síntomas asociados a Sd. de focalización neurológica de pocos dias de evolución o Sd. convulsivo que igualmente expresa un compromiso focal (27).
Se deberá solicitar TAC de cerebro inmediatamente, a fin de demostrar la presencia de una o varias imágenes que captan contraste en anillo. Si se retraza la TAC debera iniciarse el tratamiento, y reevaluarse cuando se disponga de ésta. La asociación de pirimetamina con sulfadiazina y acido folinico (leucovorin), es el tratamiento de elección; sin embargo los dos primeros no están disponibles en el Perú. Por lo que TMP-SMX en dosis de 10mg/kg/día de TMP, en dosis divididas cada 12 horas ha demostrado ser efectiva (28), sin embargo preferimos asociar Clindamicina 500 mg cada 8 horas durante las seis semanas de tratamiento. Los efectos adversos son menores que el esquema de elección. Cuando el tratamiento es certero, la mejoría clínica es evidente en una semana, con una mejoría de las imágenes radiológicas en dos semanas. La ausencia de mejoría tanto clínica como radiológica debe hacer investigar otra etiología, fundamentalmente el linfoma no-Hodgkin cerebral.
Profilaxis
El esquema de profilaxis contra PCP (ver profilaxis PCP), cubre también a la Encefalitis por toxoplasma (29), tanto en la profilaxis primaria como secundaria. De no tolerar TMP-SMX se recomienda dapsona-pirimetamina, la cual es también efectiva contra PCP (30,31). Monoterapia como profilaxis con dapsona, pirimetamina, azitromicina, o claritromicina no deben ser recomendadas. La profilaxis primaria se debe descontinar si el paciente en TARGA ha incrementado sus linfocitos CD4 > 200 cels/µL por al menos 3 meses (32,33), y la profilaxis secundaria cuando este incremento se haya mantenido por al menos 6 meses (34). Sin embargo debe ser reintroducida en cualquier caso si los linfocitos CD4 disminuyen a < 200 cels/µL.
Pneumonia por Pneumocystis jirovecii (PCP)
Diagnóstico y tratamiento
Persona que acude con síntomas de 2 a 3 semanas de duración caracterizado por la presencia de tos seca, fiebre moderada, y disnea progresiva. Se evidencia un paciente con disnea al reposo, taquipnea, generalmente no se encuentran rales repiratorios, pero contrariamente la cianosis distal puede ser muy evidente. Los exámenes auxiliares nos muestran un hemograma con ligera leucocitosis con o sin desviación izquierda, la RX no muestra alteraciones o existe inflitrado insterticial bilateral con escaso o nulo infiltrado alveolar. Con estas evidencias se puede plantear el diagnóstico, sin embargo son muy sugestivas una disminución de la PaO2 así como incremento significativo de la DHL. La observación del agente a través de una coloración de methenamina plata del esputo se aprecia en el 50% de los casos, siendo el lavado broncoalveolar el procedimiento de mejor rendimiento de 89 a 98% (35).
El tratamiento de elección es: TMP-SMX en dosis equivalentes a 15 a 20 mg/kg de peso de TMP, la que se puede repartir cada 8 horas por 3 semanas. Si el paciente se encuentra con una FR mayor de 30x´ o una PaO2 < de 70 mmHg o gradiente alveolo-arterial de Oxigeno > 35 mmHg, se recomienda el uso de: a) Prednisona a dosis de 40 mg dos veces al día por 5 días, luego 40 mg diarios del día 6to al 10mo y 20 mg del día 11vo al 21vo. ó b) Metilprednisolona 240mg diario los 3 primeros días, 120 mg/día del 4to al 6to y 60 mg/día del 7mo al 9no. El beneficio de la corticoterapia es evidente en disminuir la tasa de mortalidad, así como en la prevención de una hipoxia mayor y fibrosis pulmonar. La respuesta al tratamiento se objetiva en los primeros 4 a 8 dias (36), lo cual nos da seguridad en el diagnóstico, de lo contrario habría que insistir en otras patologías como una NAC, TB pulmonar, micosis u otras. Para lo cual el lavado broncoalveolar es mandatorio o la decisión de ampliar la cobertura se justifica. De insistir en la impresión diagnóstica y no mejorar clínicamente o presentar reacción adversa severa al TMP-SMX se recomienda cambiar a pentamidina, o dapsona más TMP, o Atovaquona asumiendo un fracaso a la terapia. Sin embargo estas asociaciones no son fácilmente disponibles, por lo que clindamicina + primaquina sería la elección (37,38). Se recomienda manejo especializado.
Profilaxis y cuidados
Los datos son insuficientes para recomendar que un paciente con PCP no comparta la habitación con otro paciente con infección VIH, sin embargo en casos de no responder a tratamiento a TMP-SMX, recomendamos aislamiento hasta mejorar las evidencias. La Profilaxis se indica a adultos con CD <– de 200 cels/µL o una historia de candidiasis orofaringea (39,40). Una tableta diaria de TMP-SMZ de 800/160 es lo recomendado (41), confiriendo además protección para toxoplasmosis e infecciones respiratorias bacterianas (41, 42) y en nuestro medio a algunos agentes de diarrea (18). La eficacia de este medicamento es elevada, por lo que ante eventos adversos leves o moderados debe intentarse reintroducir la droga a través de esquemas de desensibilización, más del 70% de los pacientes toleran la reintroducción de la terapia (42). Si no se tolera se recomienda dapsona 100mg diario ó dapsona 200mg más pirimetamina 75mg más leucovorin 25mg una vez por semana (30,31), este último esquema a la vez protege contra toxoplasmosis. La pentamidina en aerosol y atovaquona son eficaces, pero su costo limita su uso. Otros regímenes deberán ser manejados con cuidado. La profilaxis primaria o secundaria pudiera descontinuarse en quienes responden a la TARGA habiendo incrementado el CD4 >200 cels/µL por al menos 3 meses (43). La profilaxis debe reintroducirse si los CD4 disminuyen a <200 cels/µL.
Retinitis por CMV
Es la forma clínica más común de enfermedad por CMV en las PVVS y usualmente ocurre cuando el CD4 cae a < 50 cels/µL (44). La evolución sin tratamiento lleva a la ceguera en 4 a 6 meses. El diagnóstico se basa en la apariencia característica del fondo de ojo. El paciente debe ser educado, en evaluar su agudeza visual regularmente a través de simples lecturas y regulares exámenes de fondo de ojo. El tratamiento recomendado es ganciclovir IV en dosis de 7,5 a 15 mg/kg/día por 2 a 3 semanas.
Profilaxis
Luego de la terapia de inducción, se recomienda como profilaxia secundaria ganciclovir IV 5 a 6 mg/kg/día por 5 a 7 días por semana (45), o ganciclovir oral a dosis de 1000 mg TID (46) . En nuestro medio se ha logrado alguna experiencia en la administración intraocular de ganciclovir, la cual debiera siempre ser asociada al tratamiento sistémico (47). La Profilaxis secundaria puede ser descontinuada ante un recuento de linfocitos CD4 > 100-150 cels/µL de manera sostenida por > 6 meses, en respuesta a la TARGA (48,49). La restauración de la profilaxis secundaria debiera realizarse cuando el recuento de CD4+ ha disminuido a <100-150 cels/µL.
Bibliografía
- Nimri LF, Moura IN, Huang L. et al. Genetic Diversity of Pneumoccystis carinii f. sp hominis based on variations in nucleotide sequences of internal transcribed spacers of rRNA genes. J. Clin Microbiol. 2002;40:1146-51.
- Maenza JR, Keruly JC, Moore RD. et al. Risk factors for fluconazole-resistant candidiasis in human immunodeficiency virus-infected patients. Clin Infect Dis. 1996;173:219.
- Mazur H, Ognibene FP, Yarchoan R. et al. CD4+ T Lymphocyte counts as predictors of opportunistic pneumonias in human immunodeficiency virus (HIV) infection. Ann Intern Med. 1989;111:223-31.
- CDC. USPHS/IDSA guidelines for the prevention of opportunistic infections in persons infected with human immunodeficiency virus. MMWR 1999;48(No. RR-10):1-59.
- Centers for Disease Control and Prevention. Guidelines for preventing opportunistic infections among HIV-infected persons, 2002. Recommendations of the U.S. Public Health Service and the Infectious Diseases Society of America. MMWR Recomm Rep 200 Jun 214;51(RR-8):1-52.
- McNaghten AD, Hanson DL, Jones JL, Dworkin MS, Ward JW. and the Adult/Adolescent Spectrum of Disease Group. Effects of antiretroviral therapy and opportunistic illness primary chemoprophylaxis on survival after AIDS diagnosis. AIDS 1999;13(13):1687-95.
- Top HIV Med. 2004;12(5):136 f 141. Copyright 2004, Internacional AIDS Society-USA.
- Hopewell PC, Chaisson, RE. Tuberculosis and human immunodeficiency virus infection. In Reichman LB, Hershfield ES, eds. Tuberculosis: A comprehensive internacional approach 2nd ed. New York; Marcel Dekker, 2000:525-52.
- Campos P, Suárez P, Sánchez J, Zavala D, Arévalo J, Ticona E, Nolan C, Otón T, Holmes, K. Multidrug Resistant Mycobacterium tuberculosis in HIV-Infected persons in Perú: Prevalence and Risk Factors. Emerg Infect Dis 2003;9(12):1571-78.
- Ticona E. Evolución de la multiresistencia de cepas de M. tuberculosis en pacientes con infección VIH en el Hospital Dos de Mayo de Lima, Perú. IX Congreso Panamericano de Infectología y I Congreso Panamericano de SIDA, Guatemala, Mayo de 1999.
- Bonifacio N, Bonifacio D, Ticona E, Mendoza V, Maguiña C. Comportamiento clínico radiológico de la tuberculosis pulmonar en pacientes VIH seropositvios y VIH sero negativos. Bol Soc Per Med Intern 1997;10:65-70.
- L Clifford, McDonald, Lenox Archibald, Sunthorn Rheanpumikankit et al. Inrecognised Mycobacterium tuberculosis bacteraemia among hospital inpatients in less developed countries. The Lancet. 1999;354:1159-63.
- Prego V, Glatt A, Roy V, Thelmo W, Dincsoy H, Raufman JP. Comparative yield of blood culture for fungi and mycobacteria, liver biopsy and bone marrow biopsy in the diagnosis o fever of undetermined origin in human immunodeficiency virus-infected patients. Arch Intern Med. 1990;150:333-6.
- Vargas D, García L, Gilman R, Ticona E, Ñavincopa M, Luo R, Caviedes L, Hong C, Escombe R, Moore D. Diagnosis of sputum-scarce HIV-associated pulmonary tuberculosis in Lima, Peru. Lancet 2005;365:150-2.
- CDC. Targeted tuberculin testing and treatment of latent tuberculosis infection. MMWR 2000;49(No RR-6):1-54.
- CDC. Prevention and treatment of tuberculosis among patients infected with human immunodeficiency virus: principles of therapy and revised recommendations. MMWR 1998;47;(RR-20):1-51.
- Havlir DV, Dube MP, McCutchan JA. et al. Prophylaxis with weekly versus daily fluconazole for fungal infections in patients with AIDS. Clin Infect Dis 1998;27(6):1369-75.
- Willingham FF, Ticona E, Taylor D, Bowen A, Crane A. et al. Diarrhea and Clostridium difficile Infection in Latin American Patients with AIDS. Clinical Infectious Diseases 1998;27:487-93.
- Rossignol JF, Hidalgo H, Feregrino M. et al. A double-blind placebo-controlled study of nitazoxanide in the treatment of cryptosporidial diarrhoea in AIDS patients in Mexico. Trans R Soc Trop Med Hyg. 1998;92:663-6.
- Molina JM, Chastang C, Goguel J. et al. Albendazole for treatment and prophylaxis of microsporidiosis due to Encephalitozoon instestinalis in patients with AIDS: A randomized double-blind controlled trial. J Infect Dis 1998;177:1373-7.
- Carr A, Marriott D, Field A. et al. Treatment of HIV-1 associated microsporidiosis and cryptosporidiosis with combination antiretroviral therapy. Lancet. 1998;351:256-61.
- Powderly WG, Finkelstein DM, Feinberg J. et al. A randomized trial comparing fluconazole with clotrimazole troches for the prevention of fungal infections in patients with advanced human immunodeficiency virus infection. N Engl J Med 1995;332(11):700-5.
- Powderly WG, Saag MS, Cloud GA. et al. A controlled trial of fluconazole or amphotericin B to prevent relapse of cryptococcal meningitis in patients with the acquired immunodeficiency syndrome. N Engl J Med 1992;326(12):793-8.
- Saag MS, Cloud GA, Graybill JR. et al. A comparison of itraconazole versus fluconazole as maintenance therapy of AIDS-associated cyrptococcal meningitis. National Institute of Allergy and Infectious Diseases Mycoses Study Group. Clin Infect Dis 1999;28(2):291-6.
- Aberg JA, Price RW, Heeren DM. et al. Discontinuation of antifungal therapy for cryptococcosis after immunologic response to antiretroviral therapy [Abstr. 250]. In: Program and Abstracts of the 7th Conference on Retroviruses and Opportunistic Infections, January 30-February 2, 2000; San Francisco, CA.
- Mussini C, Cossarizza A, Pezzotti P. et al. Discontinuation or continuation of maintenance therapy for cryptococcal meningitis in patients with AIDS treated with HAART [Abstr. 546]. In: Program and Abstracts of the 8th Conference on Retroviruses and Opportunistic Infections, February 4-8, 2001; Chicago, IL.
- Luft BJ, Remington JS. Toxoplasmic encephalitis in AIDS (AIDS commentary) Clin Infect Dis. 1992;15:211-22.
- Torre D, Casari S, Speranza F. et al. Randomized trial of trimethoprim-sufametoxazole versus pyrimetamine-sulfadiazine for therapy for toxoplasmic encephalitis in patients with AIDS. Italian collaborative study group. Antimicro Agents Chemother. 1998;42:1346-49.
- Carr A, Tindall B, Brew BJ. et al. Low-dose trimethoprim-sulfamethoxazole prophylaxis for toxoplasmic encephalitis in patients with AIDS. Ann Intern Med 1992;117(2):106-11.
- Podzamczer D, Salazar A, Jimenez J. et al. Intermittent trimethoprim-sulfamethoxazole compared with dapsone-pyrimethamine for the simultaneous primary prophylaxis of Pneumocystis pneumonia and toxoplasmosis in patients infected with HIV. Ann Intern Med 1995;122(10):755-61.
- Opravil M, Hirschel B, Lazzarin A. et al. Once-weekly administration of dapsone/pyrimethamine vs. aerosolized pentamidine as combined prophylaxis for Pneumocystis carinii pneumonia and toxoplasmic encephalitis in human immunodeficiency virus-infected patients. Clin Infect Dis 1995; 20(3):531-41.
- Kirk O, Lundgren JD, Pederson C, Nielsen H, Gerstoft, J. Can chemoprophylaxis against opportunistic infections be discontinued after an increase in CD4 cells induced by highly active antiretroviral therapy? AIDS 1999;13(13):1647-51.
- Soriano V, Dona C, Rodriguez-Rosado, et al. Discontinuation of secondary prophylaxis for opportunistic infections in HIV-infected patients receiving highly active antiretroviral therapy. AIDS 2000, 14(4):383-6.
- Kaplan JE, Masur H, Holmes KK. Guidelines for preventing opportunistic infections among HIV-infected persons f 2002: Recommendations of the U.S. Public Health Service and the Infectious Disease Society of America. MMWR Recomm Rep. 2002;51:1-52.
- Broaddus C, Dake MD, Stulburg MS. et al. Bronchoalveolar lavage and transbronchial biopsy for the diagnosis of pulmonary infections in the acquired inmunodeficiency síndrome. Ann Intern. Med 1986;102:747-52.
- Kovacs JA, Hiemenz JW, Macher AM. et al. Pneumocystis carinii pneumonia: A comparison between patients with the acquired immunodeficiency syndrome and patients with other inmunodeficiencies. Ann Intern Med. 1998;100:663-71.
- Safrin S, Finkelstein DM, Feinberg J. et al. Comparison of three regimens for treatment of mild to moderate Pneumocystis carinii pneumonia in patients with AIDS: A double blind, randomized trial of oral trimethoprim f sulfamethoxazole. Dapsone-trimetroprim, clinddamycin-primaquine. ACTG 108 Study Group. Ann Intern Med. 1996;124:792-802.
- Noskin GA, Murphy RL, Black JR, Phair JP. Salvage therapy with clindamycin/primaquine for Pneumocystis carinii pneumonia Clin Infec Dis. 1992;14:183-8.
- Phair J, Munoz A, Saah A, Detels R, et al. and the Multicenter AIDS Cohort Study Group. The risk of Pneumocystis carinii pneumonia among men infected with HIV-1. N Engl J Med 1990;322(3):161-5.
- Kaplan JE, Hanson DL, Navin TR, Jones JL. Risk factors for primary Pneumocystis carinii pneumonia in human immunodeficiency virus-infected adolescents and adults in the United States: reassessment of indications for chemoprophylaxis. J Infect Dis 1998;178(4):1126-32.
- Bozzette SA, Finkelstein DM, Spector SA. et al. A randomized trial of three antipneumocystis agents in patients with advanced human immunodeficiency virus infection. N Engl J Med 1995;332(11):693-9.
- Hardy WD, Feinberg J, Finkelstein DM. et al. for the AIDS Clinical Trials Group. A controlled trial of trimethoprim-sulfamethoxazole or aerosolized pentamidine for secondary prophylaxis of Pneumocystis carinii pneumonia in patients with the acquired immunodeficiency syndrome: AIDS Clinical Trials Group protocol 021. N Engl J Med 1992;327(26):1842-8.
- Ledergerber B, Mocroft A, Reiss P, Furrer H, Kirk O, Bickel M, Uberti-Foppa C, Pradier C, dArminio Monforte A, Schneider M, Lundgren, J. Discontinuation of secondary prophylaxis against Pneumocystis carinii pneumonia in patients with HIV infection who have a response to antiretroviral therapy. NEJM 2001;344(3):168-74.
- Gallant JE, Moore RD, Richman DP. et al. Incidence and natural history of cytomegalovirus disease in patiens with advanced human immunodeficency virus disease treated with zidovudine. J Infect Dis. 1992;166: 1223-7.
- Mills J, Jacobsen MA, O’Donnell JJ. et al. Treatment of cytomegalovirus retinitis in patients with AIDS. Rev Infect Dis. 1988; 3: 5522-31.
- Drew WI, Ives D, Lalezari JP. et al. Oral ganciclovir as maintenance treatment for cytomegalovirus retinitis in patients with AIDS. N Engl J Med. 1995;333:615-20.
- Martin DF, Kupperman BD, Wolitz RA. et al. Oral ganciclovir for patients with cytomegalovirus retinitis treated with a ganciclovir implant. Roche Ganciclovir Study Group. N Engl J Med 1999;340(14):1063-70.
- Whitcup SM, Fortin E, Lindblad AS. et al. Discontinuation of anti-cytomegalovirus therapy in persons with HIV infection and cytomegalovirus retinitis. JAMA 1999;282:1633-7.
- Jouan M, Saves H, Tubiana R. et al. Discontinuation of maintenance therapy for cytomegalovirus retinitis in HIV infected patients receving highly active antiretroviral therapy. Restimop Study Team. AIDS 2001;15(1):23-31.
Profesor Asociado de Medicina Universidad de San Martín de Porres.
Médico Asistente del Servicio de Enfermedades Infecciosas y Tropicales del Hospital Nacional Dos de Mayo. |
