Monitoreo continuo de la glicemia en el poblador de los andes
Oscar Castillo 1, 2, Orison Woolcott 3, Elizabeth Gonzáles 1, Victoria Tello 3,
Lida Tello 3, Carmen Villarreal 1, Nicolás Mendez 4, Lucy Damas 5, Edgar Florentini 1
Resumen
Es conocido que el habitante de la altura tiene una glicemia más baja en comparación con el habitante del nivel del mar. Esta diferencia ha sido establecida teniendo en cuenta los valores basales de glicemia. Sin embargo, se desconoce si esta diferencia permanece durante el día. Por lo tanto, el objetivo principal del estudio fue comparar el perfil del monitoreo continuo de glucosa durante 12 horas. El estudio incluyó 10 varones voluntarios del nivel del mar y 10 varones de la altura (3, 250 m). La edad promedio fue 24,4 ± 1,8 años y 22,2 ± 3,2 años, y el índice de masa corporal, 22,8 ± 1,2 y 22,9 ± 2,.6 kg/m2, respectivamente. Los sujetos de la altura mostraron una menor glicemia durante las 12 horas de monitoreo en comparación con los del nivel del mar (52,4 ± 6,8 mg/dL y 73,0 ± 12,6 mg/dL, respectivamente; P < 0,001). Los niveles de triglicéridos fueron mayores en el grupo de altura pero no estadísticamente significativos (123 ± 53,9 mg/dL y 80,8 ± 27,9 mg/dL, respectivamente; P >0,05) No hubo diferencias en la sensibilidad a la insulina. En conclusión, los sujetos de la altura tuvieron una menor glicemia al menos durante las 12 h de monitoreo continuo.
Palabras clave: Glicemia, monitoreo, glucosensor, altura, insulina.
Abstract
The goal of this study was to compare the profile of 12-hours blood glucose monitoring in people living at high altitude and in people from sea level. The study included 20 healthy volunteer men: 10 from sea level and 10 from high altitude (3,250 m). The mean age was 24,4 ± 1,8 years and 22,2 ± 3,2 years, and the body mass index, 22,8 ± 1,2 and 22,9 ± 2,6 kg/m2, respectively. High altitude dwellers showed a lower glycaemia during all the 12-h monitoring (52,4 ± 6.8 mg/dL and 73,0 ± 12,6 mg/dL, P < 0,001), and higher triglycerides levels than sea level men (123 ± 53,9 mg/dL and 80,8 ± 27,9 mg/dL, respectively; P > 0,05). There were no differences on insulin sensitivity. In conclusion, dwellers from high altitude lands had a lower glycaemia at least during 12 h monitoring in comparison with sea level residents.
Key words: Glucose monitoring, glycaemia, glucosensor, altitude, insulin.
Introducción
Diversos estudios han demostrado que el habitante de la altura tiene una menor glicemia en ayunas que el habitante del nivel del mar (1-7). Incluso, existen estudios que demuestran una menor prevalencia de diabetes mellitus en la altura (8-10). Esta menor glicemia basal en la altura es debida, al menos en parte, a una mayor sensibilidad a la insulina. Esto ha sido demostrado por la prueba de tolerancia a la glucosa oral (3) e intravenosa (4,5) y por el método del clamp de la glucosa (11,12). La explicación para la mayor captación de glucosa en la altura no se conoce todavía.
Debido a que una similar insulinemia basal ha sido demostrada en los sujetos de la altura y del nivel del mar (13), la mayor sensibilidad a la insulina en la altura podría ser atribuida a los mecanismos a nivel del receptor o post-receptor de insulina. Al respecto, estudios in vitro indican que la hipoxia mejora la captación de glucosa debido a que incrementa la translocación de los transportadores de glucosa (principalmente GLUT-4) en la célula muscular esquelética (14-16) y cardiaca (17).
La diferencia en las concentraciones de glucosa entre los pobladores de la altura y los del nivel del mar ha sido basada en estudios bajo condiciones basales o bajo condiciones forzadas o no fisiológicas. Sin embargo, no se conoce si esta diferencia permanece constante durante las 24 horas del día. En las últimas décadas ha sido de gran interés el monitoreo continuo de la glicemia en los seres humanos empleando sensores de glucosa de diferentes manufacturas (18-20). Se ha demostrado que hay importantes variaciones de la glicemia tales como la hipoglicemia durante la noche o la hiperglicemia post-prandial, no detectada con muestras aisladas de glicemia (21), de tal manera que nosotros consideramos que no es suficiente el valor basal de glicemia para establecer diferencias en la glicemia entre los sujetos de la altura y los del nivel del mar, sino que es necesario realizar un monitoreo continuo.
A nuestro entender, no hay estudios previos que hayan determinado el perfil continuo de la glicemia en sujetos sanos de la altura, por lo tanto, los objetivos de este estudio fueron 1) comparar el perfil del monitoreo continuo de la glicemia durante 12 horas en sujetos de la altura y del nivel del mar y 2) comparar la sensibilidad a la insulina en ambas poblaciones usando los métodos HOMA y QUICKI.
Material y métodos
Sujetos
Este estudio incluyó a 10 varones sanos voluntarios residentes de la altura (Huancayo, 3 250 m, Presión atmosférica [Patm] = 520 mm Hg) y 10 varones, con características similares, residentes del nivel del mar (Lima, 150 m, Patm = 760 mm Hg). En ambos grupos la edad promedio fue 24,4 ± 1,8 y 22,2 ± 3.2 años y el índice de masa corporal (IMC) fue 22,8 ± 1,2 y 22,9 ± 2,6 kg/m2, respectivamente. Ningún sujeto del grupo de la altura había descendido a nivel del mar en un lapso de 3 meses previos al momento del experimento. Asimismo, ningún sujeto del grupo del nivel del mar tuvo exposición a una altura mayor de 2,000 m, por lo menos 3 meses antes del estudio. En el momento del reclutamiento ninguno de los sujetos estuvo recibiendo medicación. Todos los participantes dieron su consentimiento informado previo al estudio.
Monitoreo continuo de la glicemia
Para realizar el perfildía de la glicemia se utilizó un sensor de glucosa (Glucosensor, Unitec Ulm, Alemania). El Glucosensor Unitec (Figura 1) es un prototipo que consiste de una unidad portátil equipado con un monitor. Requiere una mínima cantidad de sangre (20-30 mL/día) proveído a través de un catéter de doble luz que es colocado en una vena periférica. Detalles adicionales han sido publicados previamente (18,22). El día previo a cada prueba se hizo una calibración con soluciones conocidas de glucosa para comprobar el correcto funcionamiento del glucosensor.
| figura 1 |
 |
| Figura 1. Glucosensor Unitec Ulm (Alemania). Prototipo de los actuales glucosensores usados para el monitoreo continuo de la glicemia in vivo y en tiempo real. |
Cada sujeto fue admitido al Laboratorio en ayuno previo de 12 horas. La prueba se inició con la inserción de dos catéteres en cada vena antecubital, uno de ellos para el monitoreo de la glicemia (catéter de doble lumen con aguja N° 18 GA como guía) y el otro catéter (20 GA) para colectar las muestras de sangre para el estudio bioquímico adicional de insulina y triglicéridos. La sangre venosa era bombeada hacia el glucosensor que dispone de una membrana conteniendo la enzima glucosa-oxidasa para determinar de forma continua la glicemia. Al mismo tiempo, por el otro lumen del mismo catéter se infundía una solución salina heparinizada (100 UI/mL) para mantener el flujo continuo de la sangre. El otro catéter también se heparinizaba cada vez que se extraía una muestra de sangre.
El monitoreo de la glicemia empezó a las 08:30 h. Se hizo una calibración previa al inicio del monitoreo usando dos muestras capilares de glicemia y luego lecturas pre- y post-prandiales (2 h post ingesta de los alimentos) determinadas por un glucómetro (Reflolux-S, Boehringer-Mannheim, Alemania), para verificar el adecuado funcionamiento del glucosensor. En algunos casos se hicieron calibraciones adicionales durante el monitoreo cuando la alarma advirtió valores menores de 40 mg/dL. Durante el monitoreo de la glicemia los sujetos recibieron 3 comidas: desayuno, almuerzo y cena, con un aporte calórico de 30 kcal por kilogramo de peso corporal individual. La distribución del total de calorías fue dada como sigue: desayuno 25% (09.00 h), almuerzo 45% (13.00 h) y cena 30% (18.00 h). El consumo de agua fue ad libitum.
Todas las lecturas de glucosa mostradas en el monitor del Glucosensor fueron en ‘tiempo real”, quedando almacenadas en la memoria las lecturas promedio de cada minuto. El registro de los datos del Glucosensor fue vaciado a una PC en el formato ASCII exportable al programa Excel (1985-1999 Microsoft Corporation).
Estados pre- y post-prandiales
Para determinar la insulinemia y trigliceridemia pre- y post-prandiales, se tomaron muestras de sangre venosa inmediatamente antes y después de las tres comidas. Las muestras de sangre fueron colectadas en tubos no heparinizados de 10 mL, se dejaron en reposo 30 minutos, luego fueron centrifugados y el suero obtenido almacenado inmediatamente a -20°C para su análisis posterior. La insulina fue determinada por el método de radio-inmunoensayo (Diagnostic Product Corporation, California, E.U.A.) y los triglicéridos por el método convencional (23).
Sensibilidad a la insulina
La sensibilidad a la insulina fue estimada usando dos métodos: HOMA (Homeostasis Model Assessment) y QUICKI (Quantitative Insulin Sensitivity Check Index). El HOMA está basado en la siguiente fórmula: I0 x G0/22,5, donde I0 es la insulinemia basal en mUI/L y G0 es la glicemia basal expresada en mmol/L (24). El QUICKI utiliza la siguiente fórmula: 1/[Log I0 + Log G0], donde I0 es la insulinemia basal expresada en las mismas unidades y G0 es la glicemia basal expresada en mg/dL (25). Finalmente, se hizo una comparación entre ambos índices en los dos grupos.
Análisis Estadístico
Todos los datos fueron expresados como promedio más su desviación estándar. Se utilizó la prueba t de Student para determinar las diferencias de los promedios en ambos grupos (SPSS 9.0, Illinois, E.U.A). Un valor de P menor de 0,05 fue considerado estadísticamente significativo. El r de Pearson fue usado para determinar la correlación entre los dos índices de sensibilidad a la insulina.
Resultados
Los sujetos de la altura tuvieron una menor glicemia basal en comparación con los del nivel del mar (50,0 ± 3,7 y 67,5 ± 8,6, respectivamente; P < 0,0001). Diferencias similares en la glicemia se obtuvieron en todos los estados pre- y post-prandiales (Tabla 1). Los habitantes de la altura mostraron una menor glicemia durante las 12 horas de monitoreo continuo (52,4 ± 6,8 mg/dL) en comparación con los habitantes del nivel del mar (73,0 ± 12,6 mg/dL; P < 0,001) (Figura 2). Los triglicéridos basales fueron más elevados en el grupo de la altura, aunque no fue estadísticamente significativo (123,0 ± 53,9 [n = 10] vs. 80,8 ± 27,9 [n = 9]; P > 0,05). De igual forma, no hubo diferencias en los triglicéridos entre ambos grupos en los estados pre- y post-prandiales posteriores (Tabla 1).
| TABLA 1 |
| |
Altura (3,250) |
n |
Nivel del mar
(150 m) |
n |
Valor de P |
| Glicemia (mg/dL) |
|
|
|
|
|
Basal
Post-Desayuno
Pre-Almuerzo
Post-Almuerzo
Pre-Cena
Post-Cena |
50,0 ± 3,7
54,8 ± 9,1
50,4 ± 5,6
56,8 ± 8,5
51,8 ± 5,3
50,7 ± 5,4 |
10
10
10
10
10
10 |
67,5 ± 8,6
71,2 ± 12,9
68,2 ± 11,0
74,1 ± 11,5
77,4 ± 7,9
79,9 ± 18,9 |
10
10
10
10
10
10 |
<0,0001
<0,005
<0,0005
<0,005
<0,00001
<0,0005 |
| Insulinemia (µUI/mL) |
|
|
|
|
|
Basal
Post-Desayuno
Pre-Almuerzo
Post-Almuerzo
Pre-Cena
Post-Cena |
8,1 ± 5,8
22,3 ± 13,3
18,7 ± 17,3
32,4 ± 24,2
18,8 ± 14,1
25,5 ± 17,0 |
9
10
9
10
9
8 |
8,4 ± 9,3
17,4 ± 9,1
18,8 ± 17,3
22,8 ± 12,3
20,9 ± 16,61
26,8 ± 31,6 |
9
9
9
9
10
10 |
<0,05
<0,05
<0,05
<0,05
<0,05
<0,05 |
| Trigliceridemia (mg/dL) |
123,0 ± 53,9
134,5 ± 84,8
150,8 ± 70,6
159,6 ± 86,9
144,0 ± 96,8
142,3 ± 79,6 |
10
10
10
10
9
9 |
80,8 ± 27,9
95,4 ± 37,3
117,8 ± 45,4
135,4 ± 83,4
105,4 ± 77,9
116,4 ± 79,6 |
9
9
9
9
10
10
|
<0,05
<0,05
<0,05
<0,05
<0,05
<0,05 |
|
| Glicemia, insulinemia y trigleceridemia pre- y post-prandiales en sujetos residentes de la altura (Huancayo, 3 250 m) y nivel del mar (Lima, 150 m). La diferencia entre los promedios en ambos grupos se calculó con la prueba t de Student. P<0,05 fue considerado estadísticamente significativo. |
| figura 2 |
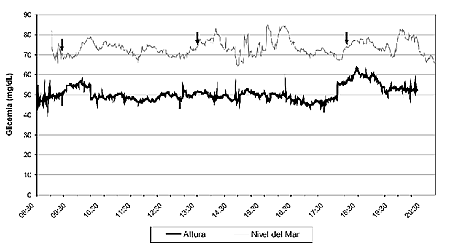 |
| Figura 2. Perfil del monitoreo continuo de la glicemia en sujetos residentes de la altura (Huancayo, 3,250 m) y del nivel del mar (Lima, 150 m). En cada perfil, las flechas indican los momentos en que los alimentos fueron ingeridos (desayuno, almuerzo y cena). |
No hubo diferencias en la insulinemia basal en ambos grupos ni en los estados pre-y post-prandiales (Tabla 1). Asimismo, no hubo diferencias en el índice de sensibilidad entre los dos grupos usando los métodos HOMA [n= 9] (1,32 ± 0,46 ; 1,01 ± 0,25) y QUICKI [n= 9] ; 0,38 ± 0,012 ; 0,40 ± 0,014 ). Sin embargo, cuando se compararon ambos índices a nivel del mar (r = -0.95 [n=9]; P < 0,0005) y en la altura (r = -0,97 [n=9]; P < 0,0001) se correlacionaron perfectamente.
Discusión
En condiciones basales, la glicemia fue más baja en el grupo de la altura que en el grupo del nivel del mar. Estos hallazgos son respaldados por numerosos autores (1,2,4-6). No encontramos diferencias en la insulinemia basal entre ambos grupos, tal como ha sido reportado previamente (26). Asimismo, no pudimos encontrar diferencias entre los niveles de triglicéridos basales. Similares resultados han sido publicados previamente (27,28). También hay reportes de niveles basales de triglicéridos elevados en sujetos nativos de altura, en obesos y diabéticos (29,30,31), aunque los sujetos del nivel del mar y los de la altura no tenían características comparables en edad ni en IMC, por lo que los resultados podrían haber sido influenciados por estas variables además de la hipoxia.
El perfil de la glicemia fue menor en los sujetos de la altura que en los sujetos del nivel del mar durante todo el monitoreo continuo de 12 horas. Una explicación para la menor glicemia en la altura con similares valores de insulinemia podría ser dada por diferencias a nivel del receptor de insulina o a nivel post-receptor (tales como los transportadores de glucosa, sustratos del receptor de insulina u otros mediadores intracelulares). In vitro, se ha demostrado que la hipoxia incrementa la translocación del GLUT-4 (transportador de glucosa) a nivel de las células musculares esqueléticas (14,16,17). Es importante remarcar que los sujetos de la altura incluidos en este estudio viven bajo una presión atmosférica que es 31,5 % menor que a nivel del mar, consecuentemente bajo condiciones de “hipoxia fisiológica”. Nosotros creemos que la altura ejerce sus efectos principalmente a través de la hipoxia.
Por otro lado, no hubo diferencias en la sensibilidad a la insulina entre los sujetos de la altura y los del nivel del mar. Esto podría deberse al número reducido de sujetos estudiados, pues se sabe que hay una excelente correlación de las pruebas HOMA y QUICKI con el clamp de la glucosa (24,25,32-34). Prueba de ello, es que en un estudio realizado en 105 mujeres nativas y residentes de la región del Cuzco (3,400 m, Perú), y 105 nativas del Cuzco pero residentes a nivel del mar, este último grupo tuvo un índice HOMA mayor que el primero, indicando una mayor resistencia a la insulina (35).
En conclusión, los sujetos de la altura tuvieron una menor glicemia durante todo el monitoreo continuo de 12 horas en comparación con los sujetos del nivel del mar. Sin embargo, no se pudo demostrar una mayor sensibilidad a la insulina en el grupo de la altura usando los métodos HOMA y QUICKI. No hubo diferencias en los niveles séricos de insulina y triglicéridos entre ambos grupos.
Agradecimientos
Este trabajo fue financiado por la Fundación Alexander von Humboldt, Alemania, y la Fundación Instituto Hipólito Unanue, Perú.
Bibliografía
- San Martín MS. Distribución de la glucosa sanguínea y su variación con el cambio de altitud. An Fac Med Lima 1940;23:312.
- Monge CC. Glucosa, ácido láctico y ácido pirúvico a nivel del mar y en la altura. An Fac Med Lima 1949;32:1.
- Picón-Reátegui E. Studies on the metabolism of carbohydrates at sea level and at high altitudes. Metabolism 1962;11:1148-54.
- Picón-Reátegui E. Intravenous glucose tolerance test at sea level and at high altitudes. J Clin Endocrinol Metab 1963;23:1256-1261.
- Calderón R, Llerena A. Carbohydrate metabolism in people living in chronic hypoxia. Diabetes 1965;14:100-5.
- Garmendia F, Arroyo J, Muro M. Glicemia del nativo normal de altura. Arch Inst Biol Andina 1970;3:209-16.
- Heat DA, Williams DR (ed). Man at high altitude: the pathophysiology of acclimatization and adaptation. Churchill Livingstone, New York, 1981:223-8.
- Solís J, Guerra-García R. Prevalencia de diabetes mellitus en hospitalizados de las grandes alturas. Arch Inst Biol Andina 1979;9:21-30.
- Seclén S, Leey J, Villena A. et al. Prevalencia de obesidad, diabetes mellitus, hipertensión arterial e hipercolesterolemia como factores de riesgo coronario y cerebrovascular en población adulta de la costa, sierra y selva del Perú. Acta Médica Peruana 1999;17:8-12.
- Zubiate M. Diabetes mellitus and high altitude. Diabetol Croat 2001;30.23-28.
- Castillo O, Alzamora J, Capatinta C. et al. Insulin sensitivity at high altitude. Abstract book of the 5th European Congress of Endocrinology, May 9-13, 1998, Sevilla, Spain. P3-80.
- Torres J, Castillo O, Woolcott O. et al. Sensibilidad a la insulina en altura y a nivel del mar [Abstract]. High Alt Med Biol 2002;3:97-138. P76.
- Garmendia F, Torres J, Tamayo R, Urdanivia E. Carbohydrate metabolism at high altitude. Abstract book of the 8th Congress of the International Diabetes Federation, July 15-20, Brussels, Belgium, 1973:262.
- Cartee GD, Douen AG, Ramlal T. et al. Stimulation of glucose transport in skeletal muscle by hypoxia. J Appl Physiol 1991;70:1593-600.
- Azevedo JL, Carey JO, Pories WJ. et al. Hypoxia stimulates glucose transport in insulin-resistant human skeletal muscle. Diabetes 1995;44:695-8.
- Reynolds TH, Brozinick JT, Jr Rogers MA, Cushman SW. Mechanism of hypoxia-stimulated glucose transport in rat skeletal muscle: potential role of glycogen. Am J Physiol 1998;274:773-8.
- Zhang JZ, Behrooz A, Ismail-Beigi F. Regulation of glucose transport by hypoxia. Am J Kidney Dis 1999,34:189-202.
- Zier H, Kerner W, Bruckel J, Pfeiffer EF. “Glucosensor Unitec Ulm”. A portable continuously measuring glucose sensor and monitor. Biomed Tech (Berl) 1990;35:2-4.
- Mastrototaro, J. The Minimed continuous glucose monitoring system (CGMS). J Pediatr Endocrinol Metab 1999;12(3):751-8.
- Maran A, Crepaldi C, Tiengo A. et al. Continuous subcutaneous glucose monitoring in diabetic patients. Diabetes Care 2002;25:347-52.
- Bolinder J, Hagstrom-Toft E, Ungerstedt U, Arner P. Self-monitoring of blood glucose in type I diabetic patients: comparison with continuous microdialysis measurements of glucose in subcutaneous adipose tissue during ordinary life conditions. Diabetes Care 1997;20:64-70.
- Bruckel J, Zier H, Kerner W, Pfeiffer EF. Progress in practical endocrinology. The Glucosensor Unitec Ulm -a portable monitor for continuous blood glucose measurement. Horm Metab Res 1990;22:382-4.
- Wahlefeld AW, Bergmeyer HU (eds). Methods of enzymatic analysis. 2nd English ed. New York, NY : Academic Press Inc, 1974 :1831.
- Matthews DR, Hosker JP, Rudenski AS. et al. Homeostasis model assessment: insulin resistance and &-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412-19.
- Katz A, Nambi SS, Mather K. et al. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 2000;85:2402-10.
- Braun B; Butterfield, GE; Dominick, SB; et al. Women at altitude: changes in carbohydrate metabolism at 4,300-m elevation and across the menstrual cycle. J Appl Physiol 1998;85:1966-73.
- Piedra A, Marticorena E, Muro M, Díaz C, Picón-Reategui E, Liñan A, Hilario V. Lípidos en individuos normales de altura y de nivel del mar a propósito del proceso de envejecimiento en la altura. Arch. Biol. Andina. 1981;11:20-5.
- Jo N, Garmendia F, Damas G. et al. Menor resistencia insulínica en el obeso de altura. An Fac Med Lima 1997;58:109-11.
- Garmendia F, Tupayachi W, Pando R, Jo N, Lazarte R. Estudio de la lipemia postprandial. I Jornadas de Investigación en Salud. Facultad de Medicina, UNMSM. 1999:32.
- Garmendia F, Crispin S, Flores R, Jamieson C, Blufstein N, Pando R. Lipemia postprandial en obesos. II Jornadas de Investigación en Salud, Facultad de Medicina, UNMSM 2000:72.
- Garmendia F, Pando R, Torres W, Valqui W, Jamieson C, Blufstein N. Lipemia postprandial en diabetes mellitus tipo 2. IV Jornadas de Investigación en Salud, An Fac Med, Supl. 2002;63:34.
- Emoto M, Nishizawa Y, Maekawa K. et al. Homeostasis model assessment as a clinical index of insulin resistance in type 2 diabetic patients treated with sulfonylureas. Diabetes Care 1999;22:818-22.
- Bonora E, Targher G, Alberiche M. et al. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity: studies in subjects with various degrees of glucose tolerance and insulin sensitivity. Diabetes Care 2000;23:57-63.
- Radziuk J. Insulin sensitivity and its measurement: structural commonalities among the methods. J Clin Endocrinol Metab 2000; 85:4426-33.
- Lindgarde F, Ercilla MB, Correa LR, Ahren B. Body adiposity, insulin, and leptin in subgroups of peruvian amerindians. High Alt Med Biol 2004;5:27-31
1 Miembro investigador del Instituto Nacional de Biología Andina, Universidad Nacional Mayor de San Marcos, Lima-Perú.
2 Médico asistente del Servicio de Endocrinología, Hospital Nacional Arzobispo Loayza, Lima-Perú. 3 Investigador colaborador
del Instituto Nacional de Biología Andina, Universidad Nacional Mayor de San Marcos, Lima-Perú. 4 Servicio de Nutrición,
Hospital Nacional Arzobispo Loayza, Lima-Perú. 5 Médico asistente del Servicio de Endocrinología, Hospital Regional
EsSalud, Huancayo-Perú. |
