Radiocirugía del neurinoma del acústico
Andrés Plasencia Santa María (1), Aldo Berti Gaspard (2), Mayer Zaharia Bassan (2), Luis Pinillos Ashton (2), Alfredo Moscol Ledesma (2), Alejandro Castillo Gutiérrez (1), César Picón Chávez (3), Ricardo Cabello Mattos (3), Sandra Guzmán Calcina (3)
Introducción
El Schwannoma vestibular o neurinoma del acústico (NA) es un tumor benigno infrecuente originario de las células de Schwann que crece rodeando al nervio vestibular usualmente primero dentro del canal auditivo interno, extendiéndose luego al ángulo pontocerebeloso. Tiene preponderancia por el sexo femenino y aparece alrededor de la 5ta década de vida. El 2-4% de estos pacientes son portadores de neurofibromatosis II, caracterizado por su bilateralidad, multiplicidad y mayor invasividad. Los síntomas son: pérdida auditiva del tipo neurosensorial, la cual puede acompañarse de tinnitus, mareos, inestabilidad, dolor opresivo en el oído afectado. A medida que el tumor crece, el paciente podría experimentar trastornos en la sensibilidad facial, cefalea, diplopía, ataxia y disfagia (1).
La elección de la mejor modalidad terapéutica para el NA sigue siendo controversial. Las opciones incluyen microcirugía, radioterapia convencional y radiocirugía estereotáctica.
A inicios de los años 50, Lars Leksell propuso la técnica de enfocar múltiples haces radiantes hacia un blanco intracraneal estereotácticamente definido (isocentro) resultando en altas dosis de radiación para un blanco intracraneal definido (lesión a tratar) pero inocuas hacia el tejido sano. Este concepto, radiocirugía estereotáctica (RE) culminó en el desarrollo del Gamma Knife (GK). En 1984 Betti y Derechinsky (2) y en 1985 Colombo y cols. (3) modificaron aceleradores lineales (LINAC) con la precisión y exactitud requerida para intervenciones radioquirúrgicas. En ambas tecnologías, las técnicas de haces intersectantes en el isocentro generan en el volumen blanco la dosis prescrita y dosis tolerables en el tejido sano (Figura 1). Empleando colimación variable, eliminando haces indeseables y pesando diferencialmente los isocentros (4), se obtienen distribuciones de dosis similares a las del GK, que se conforman a la lesión y respetan el mayor volumen posible de tejido cerebral sano (5).
Leksell trató el primer caso de NA en 1969 (6), y desde entonces, el NA es considerado un buen blanco para RE porque: 1) es bien demarcado en las neuroimágenes, 2) no infiltra los tejidos sanos vecinos, 3) los portadores usualmente están sobre los 50s, lo que hace más riesgosa la anestesia general necesaria para microcirugía; y por último, 4) la vecindad del tumor con el tronco cerebral y los nervios craneales conlleva una significativa morbimortalidad aun en manos de cirujanos expertos. Que la RE sea un procedimiento bajo anestesia local, tenga una eficacia comparable y menor riesgo que la microcirugía, la hace una modalidad atractiva.
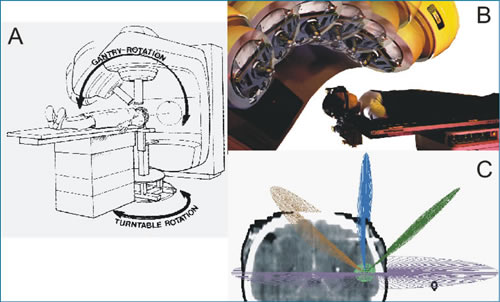 |
| Figura 1. A y B) Las rotaciones del gantry del LINAC en distintas posiciones de la camilla del paciente configuran C) los haces arqueados convergentes en el isocentro. |
Radiocirugía con Gamma Knife
El grupo de la Universidad de Pittsburg, liderado por Lunsford cuenta con la más grande serie reportada con esta tecnología (7), con 829 casos. El volumen promedio de tratamiento fue de 2.5 cm3. La dosis fue de 13 Gy (rango 10-20 Gy). Se preservó la audición, dependiendo del tamaño, en 50 al 77% de casos (hasta 90% en tumores intracanaliculares). La neuropatía facial se redujo a menos del 1% y los síntomas trigeminales a menos del 3% de aquellos pacientes cuyos tumores alcanzaron el nivel del nervio trigeminal. Se obtuvo control tumoral a 10 años en el 97% y ninguno necesitó de tratamiento adicional. Los autores atribuyen el notable éxito a largo plazo a la calidad de sus imágenes, al planeamiento volumétrico multi-isocéntrico conformal, a la precisión geométrica y dosimetría óptima, demostrando que la preservación neurológica con una buena calidad de vida a largo plazo es factible de lograr con esta modalidad.
El grupo de Kemeny de Inglaterra (8) con 234 casos seguidos en promedio 35 meses, logra una tasa de control tumoral del 92% y sólo 3% necesitaron cirugía. En grandes tumores (35 a 45 mm.), se obtuvo el control en el 75%, preservación auditiva en el 75%, paresia e hipoestesia facial persistentes en menos del 1% respectivamente y tuvieron síntomas vestibulococleares transitorios el 13% de los pacientes. Los autores concluyeron que las tasas de control tumoral son comparables a aquellas conseguidas mediante microcirugía pero que las complicaciones y morbilidad asociadas a la RE son de lejos menos frecuentes respecto de la microcirugía por lo que consideran que la RE podría llegar a ser el tratamiento de elección para el NA de tamaño pequeño e intermedio.
Radiocirugía del neurinoma acústico con linac
Las series de casos de NA tratados con LINAC son limitadas comparadas con el GK. Friedman y cols. de la Universidad de Gainesville, Florida (9) trataron a 390 pacientes. Las tasas de control actuarial a 1 y 2 años fueron ambas del 98%, y a 5 años del 90%. Sólo 4 pacientes (1%) necesitaron cirugía por crecimiento tumoral. Diecisiete pacientes (4.4%) experimentaron paresia facial y 14 pacientes (3.6%) reportaron hipoestesia facial. El riesgo de estas complicaciones se relaciona directamente al volumen tumoral y/o la dosis prescrita al tumor. Desde que las dosis fueron reducidas a 1250 cGy en 1994, sólo 2 pacientes (0.7%) tuvieron paresia facial y otros 2 (0.7%) adormecimiento facial. Se enfatiza la seguridad y eficacia de la RE como una alternativa a la microcirugía en el NA.
Spiegelmann y cols. en Israel (10,11), trataron a 44 pacientes empleando tomografía computarizada y un sólo isocentro en más del 90% de sus casos. En los primeros 24 pacientes la dosis fue de 15 a 20 Gy y en los subsecuentes, de 11 a 14 Gy. Después de 32 meses de seguimiento, se obtuvo el control tumoral en el 98% con preservación auditiva del 71%. Tuvieron paresia facial persistente el 8% en relación directa al tamaño tumoral.
Microcirugia del neurinoma del acústico
Reportes recientes en microcirugía del NA en centros con extensa experiencia confirman su eficacia y relativa baja tasa de complicaciones y morbilidad.
Los artículos de Samii sobre 1000 casos de microcirugía de NA (12, 13,14,15) muestran resección completa en el 98% de los casos y recurrencia de sólo el 1% en casos no NF-2, pero la duración del seguimiento no se señala. Hubo interrupción del nervio facial en el 7%, y de aquellos con preservación de la integridad del nervio 45% sufrieron nuevo déficit facial en su mayoría irreversible. Adicionalmente ocurrió fístula de LCR (9%), hidrocefalia (2%), meningitis bacteriana (2%), hemorragia intracraneal (2%), paresia de nervios craneales bajos (5,5%), hemiparesia (1%), cuadriparesia (0,2 %) y muerte (1%). De aquellos con audición evaluable prequirúrgicamente, el 40% preservaron la audición. Gormley y cols. (16) con 179 pacientes, estratificados por tamaño, obtuvieron resultados algo menos satisfactorios a los de Samii y puntualizan que a mayor tamaño tumoral, mayor la probabilidad de complicaciones y morbimortalidad. Desafortunadamente la erradicación quirúrgica del NA demanda mucha destreza y experiencia por parte del cirujano y existe una “curva de aprendizaje” que muestra que, a menor experiencia de éste, menor la probabilidad de éxito y mayor la de complicaciones.
Nuestra experiencia con radiocirugía del neurinoma del acústico
Hemos tratado 11 pacientes con diagnóstico radiológico de NA, 8 mujeres y 3 hombres, con edad promedio de 53,2 años con seguimiento promedio de 17 meses. Ninguno había sido explorado quirúrgicamente. El volumen promedio de los tumores fue de 4,6 cc. La dosis marginal promedio fue de 12,2 Gy. En 4 (36,4%) hubo disminución del volumen tumoral y los 7 restantes (73,6%) aún se mantienen estables. Seis (54,5%) tuvieron disminución de la captación central del contraste por necrosis tumoral. El 81% conservaron el nivel previo de audición. Hasta el momento ninguno ha presentado síntomas adversos faciales motores ni sensitivos. De 2 que presentaban disestesias faciales en el preoperatorio, uno ha remitido totalmente y el otro en forma parcial. Un paciente (9,1%) ha tenido trastorno del equilibrio y otro acúfenos. Ambos en proceso de remisión. Dos pacientes (18,2%) presentaron hipoacusia reversible y anacusia respectivamente en las primeras 2 semanas del post-operatorio (uno de ellos NF-2 con tumor bilateral), lo que atribuimos al propio ritmo de crecimiento tumoral en el preoperatorio reciente, sin poder descartar la muy rara ocurrencia de edema por radiación, pese a que ésta puede ocurrir recién a partir del 3er mes post-operatorio. El volumen tumoral en nuestra serie es significativamente mayor que en la mayor parte de series reportadas en la literatura. Aunque el aumento del volumen de tratamiento incrementa la longitud del nervio irradiado con la dosis de prescripción y esto guarda relación directa con la probabilidad de complicaciones, nuestros resultados al presente son muy satisfactorios aunque tempranos para una evaluación definitiva la cual se daría en un seguimiento más extenso. Las figuras 2, 3 y 4 muestran aspectos de la planificación y el seguimiento post RC de tres de nuestros casos.
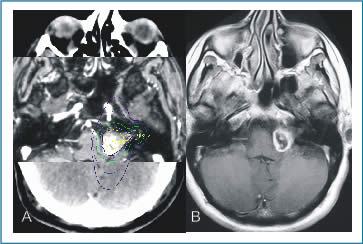 |
| Figura 2. A) Planificación de RC de NA fusionando la tomografía con la resonancia magnética. Note la buena conformalidad de la dosis prescrita al tumor y las curvas de distribución de isodosis. B) RNM de control dos años después. Necrosis central y reducción tumoral. Preservación auditiva sin complicaciones. |
 |
| Figura 3. A) RNM Pre RC y B) 2 años post RC. Observe necrosis tumoral central y reducción volumétrica con menor efecto de masa sobre el tronco y IV ventrículo. Marcada remisión de vértigo, ataxia y acúfenos |
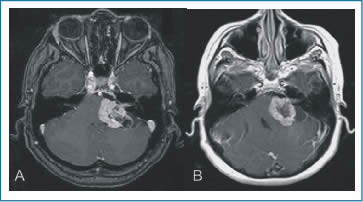 |
| Figura 4. A) NA Pre RC. B) RNM de control 3 años post RC. Note reducción tumoral (flechas). Audición preservada sin complicaciones. |
Conclusiones
1. El control tumoral a largo plazo sobre el 90% puede lograrse con radiocirugía.
2. Las tasas de neuropatía facial y trigeminal después de la RE están debajo del 5% respectivamente.
3. La preservación auditiva se logra sobre el 50%.
4. Estos resultados son superiores respecto a los mejores que pueden obtenerse con microcirugía.
5. La radiocirugía es el tratamiento de elección en caso de NA pequeños.
Bibliografía
- Mendenhall WM, Friedman WA, Amdur RJ, Antonelli PJ. Management of acoustic neuroma. Am J Otolaryngol 2004;25: 38-47.
- Betti OO, Derechinsky VE. Hiperselectiva encephalic irradiation with linear accelerator. Acta Neurochir Suppl 1984;33: 385-390.
- Colombo F, Benedetti A, Pozza F, et al. Stereotactic radiosurgery utilizing a linear accelerator. Appl Neurophysiol 1985;48:133-145.
- Friedman WA, Buati JM, Bova FJ. Linac Radiosurgery-A Practical guide. New York: Springer-Verlag, 1998.
- Friedman WA, Foote KD. Linear accelerator-based radiosurgery for vestibular schwannoma. Neurosurg Focus 2003;14(5):Article 2.
- Leksell L. A note on the treatment of acoustic tumors. Acta Chir Scand 1971;137:763-765.
- Lunsford LD, Niranjan A, Flickinger JC, et al. Radiosurgery of vestibular schwannomas: summary of experience in 829 cases. J Neurosurg. 2005;102 Suppl:195-199.
- Rowe JG, Radatz MWR, Walton L, et al. Gamma knife stereotactic radiosurgery for unilateral acoustic neuromas. J Neurol. Neurosurg. Psychiatry 2003;74; 1536-1542.
- Friedman WA, Bradshaw P, Myers A, et al. Linear accelerator radiosurgery for vestibular schwannomas. J Neurosurg. 2006;105(5):657-661.
- Spiegelmann R, Gofman J, Alezra D, et al. Radiosurgery for acoustic neurinomas (vestibular schwannomas). Isr Med Assoc 21999;J1:8-13.
- Spiegelmann R, Lidar Z, Gofman J et al. Linear accelerator radiosurgery for vestibular schwannoma. J Neurosurg 2001;94:7-13.
- Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): hearing function in 1000 tumor resections. Neurosurgery 1997;40:428-262,.
- Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): surgical management and results with an emphasis on complications and how to avoid them. Neurosurgery 1997;40:11-23.
- Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): the facial nerve-preservation and restitution of function. Neurosurgery 1997;40:684-695.
- Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): auditory and facial nerve function after resection of 120 vestibular schwannomas in patients with neurofibromatosis 2. Neurosurgery 1997;40:696-706.
- Gormley WB, Sekhar LN, Wright DC, et al. Acoustic neuromas: results of current surgical management. Neurosurgery 1997;41:50-60.
1 Dpto de Neurocirugía, 2 Dpto de Radioncología, 3 Dpto. Física Médica. Instituto de Radiocirugía del Pacífico. StereoKnife, Lima - Perú.
|
